现有部分短周期主族元素的性质与原子(或分子)结构如下表:元素编号元素性质与原子(分子)结构A族序数等
现有部分短周期主族元素的性质与原子(或分子)结构如下表:
(2)元素B和D相比,金属性较强的是______(填元素符号),可以验证该结论的实验是______. ①比较两种元素的单质的密度 ②将这两种元素的单质粉末分别和同浓度的盐酸反应 ③将在空气中放置已久的这两种元素的块状单质分别放入热水中 ④比较这两种元素的气态氢化物的稳定性 (3)元素B和A能形成化合物B2A2,将10g含有CO2和CO的混合气体,通入装有足量B2A2的干燥管,反应后干燥管的总质量增加5.6g,则原混合气体中的CO2质量分数为______ (4)向某无色透明的溶液中加入D的粉末,反应后只生成氢气.下列各组离子在该溶液中一定可以大量共存的是______ A.K+ Na+ Cl- SO42- B.Na+ Cl- SO42- HCO3- C.Na+ CO3- NO3- K+ D.Al3+ NH4+ Cl- SO42-. |
参考解答
| 短周期元素,由族序数等于周期数3倍,若A为第二周期,则位于第ⅥA族,即A为O;由周期数等于族序数3倍的元素,则B在第三周期第ⅠA族,则B为Na;由常温下气体单质为双原子分子.C的气态氢化物能使酚酞溶液变红色,则C为N;由第三周期金属元素,能和B的最高价氧化物对应的水化物NaOH溶液反应生成氢气,则D为Al, (1)C为N,有2个电子层,最外层电子数为5,原子结构示意图为 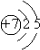 ,故答案为: 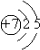 ; (2)Na、Al都在第三周期,从左向右金属性减弱,则Na的金属性强,可利用单质与水或与酸的反应,最高价氧化物对应水化物的碱性等来判断,故选②, 故答案为:Na;②; (3)设原混合气体中的CO2质量为x, 由CO2+Na2O2═Na2CO3+O2△m 44 28 x 5.6gg
则原混合气体中的CO2质量分数为
(4)向某无色透明的溶液中加入Al的粉末,反应后只生成氢气,则无色溶液可能为酸或碱的溶液, A、无论酸或碱的溶液,该组离子之间不反应,则一定能大量共存,故A正确; B、HCO3-既能与酸反应,又能与碱反应,则一定不能大量共存,故B错误; C、碱性条件下不反应,但酸溶液中CO3-与氢离子反应,则可能共存,故C错误; D、酸溶液中不反应,但碱溶液中Al3+、NH4+都能与氢氧根离子反应,则可能共存,故D错误; 故答案为:A. |
相似问题
下列各组离子能在溶液中大量共存的是( )A.Ca2+ NH4+ Cl- CO32-B.Na+ NH
下列各组离子能在溶液中大量共存的是( )A.Ca2+、NH4+、Cl-、CO32-B.Na+、NH4+、NO3-、Cl-C.H+、Na+、NO3-、OH-D.K+、Mg2+、SO42-、OH-
常温下 下列各组离子在指定溶液中一定能大量共存的是[ ]A.pH=1的溶液:Na+ NH4+
常温下,下列各组离子在指定溶液中一定能大量共存的是[ ]A.pH=1的溶液:Na+、NH4+、CO32-、NO3- B.与铝单质反应生成氢气:Na+、NH4+、Cl-、B
在下列溶液中 各组离子能够大量共存的是( )A.酸性溶液中:NO3- SO42- Fe2+ Na+
在下列溶液中,各组离子能够大量共存的是( )A.酸性溶液中:NO3-、SO42-、Fe2+、Na+B.强碱性溶液中:NH4+、NO3-、Ba2+、K+C.澄清透明的溶液中:Mn
某电解质溶液中 可能大量存在有Ag+ Cu2+ H+ CO32- OH- Cl-离子 你认为一定有的
某电解质溶液中,可能大量存在有Ag+、Cu2+、H+、CO32-、OH-、Cl-离子,你认为一定有的离子是______,一定没有的离子是______,还需要进一步确认的离子是_
下列各组离子在无色溶液中能同时大量存在的是( )A.K+ Al3+ OH- SO42-B.Cu2+
下列各组离子在无色溶液中能同时大量存在的是( )A.K+、Al3+、OH-、SO42-B.Cu2+、Fe3+、Cl-、NO3-C.Ba2+、Na+、SO42-、NO3-D.K+、Na+、CO32-、Cl-












