分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2
| 分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O,据此作答: (1)标出该反应中电子的转移方向和数目: 5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O (2)该反应的氧化剂是 。 (3)该反应的氧化产物与还原产物的质量比是 。 (4)当反应生成0.3 mol Cl2时,则转移的电子的物质的量是 。 |
参考解答
(6分)(1)(2分)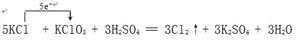 (双线桥表示也给分) (双线桥表示也给分)(2)KClO3(1分); (3)5∶1(1分); (4)0.5 mol(2分) |
试题分析:根据方程式可知,在反应中氯化钾中氯元素的化合价从-1价升高到0价,氯酸钾中氯元素的化合价从+5价,降低到0价,所以氧化剂是氯酸钾。氧化产物和还原产物都是氯气,由于还原剂和氧化剂的物质的量之比是5:1,则反应的氧化产物与还原产物的质量比是5∶1。每生成3mol氯气,转移5mol电子,则当反应生成0.3 mol Cl2时,转移的电子的物质的量是0.5mol。 点评:该题是高考中的常见题型,属于基础性试题的考查。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念判断即可。有利于培养学生的逻辑推理能力和发散思维能力。 |
相似问题
从海藻灰中可以提取碘的主要反应为:2I-+Cl2=2Cl-+I2 下列说法正确的是( )A.I-具
从海藻灰中可以提取碘的主要反应为:2I-+Cl2=2Cl-+I2,下列说法正确的是( )A.I-具有氧化性B.Cl2是还原剂C.该反应属于置换反应D.氯气的氧化性比碘强
已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气 反应
已知:还原性强弱:I->Fe2+.往100mL碘化亚铁溶液中缓慢通入3 36L(标准状况)氯气,反应完成后溶液中有12的Fe2+被氧化成Fe3+.则原碘化亚铁溶液的物质
根据下列反应:①FeCl3+2HI=2FeCl2+2HCl+I2②H2SO3+I2+H2O=2HI+
根据下列反应:①FeCl3+2HI=2FeCl2+2HCl+I2②H2SO3+I2+H2O=2HI+H2SO4③3FeCl2+4HNO3=2FeCl3+NO+2H2O+Fe(NO3)3判断有关物质还原性由强到弱的顺序是(
1986年 人们成功的用如下反应制得了氟:①2KMnO4+2KF+10HF+3H2O2===2K2M
1986年,人们成功的用如下反应制得了氟:①2KMnO4+2KF+10HF+3H2O2===2K2MnF6+8H2O+3O2②K2MnF6+2SbF5===2KSbF6+MnF4③2MnF4===2MnF3+F2↑下列说
常温下 分别在溶液中发生如下反应:(1)16H+ + 10Z- + 2XO4- ='=' 2X2++
常温下,分别在溶液中发生如下反应:(1)16H+ + 10Z- + 2XO4- ="=" 2X2++ 5Z2↑+ 8H2O,(2)2A2++ B2==2A3++ 2B-,(3)2B- + Z2== B2 +












