硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌 菱锌矿的主要成分是ZnCO3 并含少量的
硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下: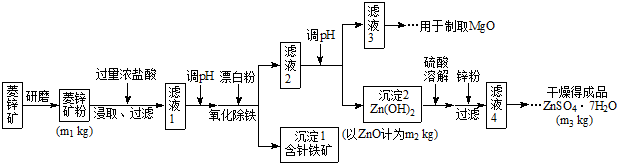 (1)将菱锌矿研磨成粉的目的是______. (2)完成“氧化除铁”步骤中反应的离子方程式: ______Fe(OH)2+______+______═______Fe(OH)3+______Cl- (3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______. (4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______.
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液 (6)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥. (7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于______. |
参考解答
| (1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分, 故答案为:增大反应物接触面积或增大反应速率或使反应更充分; (2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子, 故答案为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-; (3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH), 故答案为:FeO(OH)(或其它合理答案); (4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,pH应介于8.0≤pH<10.4, 故答案为:8.0≤pH<10.4; (5)从“滤液3”制取MgO过程中,应先生成Mg(OH)2,溶液碱性应较强,bd符合,而纯碱溶液水解呈碱性,碱性较弱,故答案为:bd; (6)“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,故答案为:蒸发浓缩、冷却结晶; (7)设碳酸锌的质量为m,利用关系式法计算: ZnCO3----ZnO 125 81 m m2 ZnCO3 的质量为
ZnCO3 的质量分数为
故答案为:
|
相似问题
下列各组反应 前后均可用同一离子方程式表示的是( )A.HCl+Na2CO3 HCl+NaHCO3
下列各组反应,前后均可用同一离子方程式表示的是( )A.HCl+Na2CO3,HCl+NaHCO3B.H2S+NaOH,H2SO4+KOHC.HCl+Na2CO3,H2SO4+K2CO3D.BaCl2+Na2SO4,BaCO3+H2SO4
下列反应的离子方程式正确的是( )A.过量二氧化碳通入偏铝酸钠溶液中:CO2+3H2O+2AlO
下列反应的离子方程式正确的是( )A.过量二氧化碳通入偏铝酸钠溶液中:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-B.用氢氧化钡溶液中和硫酸溶液:Ba2++
有下列物质A.CO2;B.稀盐酸;C.BaCO3;D.NaOH; E.铜.是电解质的有(填序号):
有下列物质A.CO2;B.稀盐酸;C.BaCO3;D.NaOH;E.铜.是电解质的有(填序号):______;是非电解质的有(填序号):______;写出B和C反应的离子方程式:______.
硝酸银溶液分别与相同体积 相同物质的量浓度的NaCl MgCl2 A1C13三种溶液恰好完全反应 三
硝酸银溶液分别与相同体积、相同物质的量浓度的NaCl、MgCl2、A1C13三种溶液恰好完全反应,三种溶液消耗的等物质的量浓度的硝酸银溶液的体积之比为(
下列化学方程式中 不能用离子方程式 Ba2++SO42-═BaSO4↓表示的是( )A.Ba(NO
下列化学方程式中,不能用离子方程式Ba2++SO42-═BaSO4↓表示的是( )A.Ba(NO3)2+H2SO4═BaSO4↓+2HNO3B.BaCl2+Na2SO4═BaSO4↓+2NaClC.BaCO3+H












