【化学–选修2:化学与技术】(15分)重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O) 是重要的化工
| 【化学–选修2:化学与技术】(15分) 重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下: 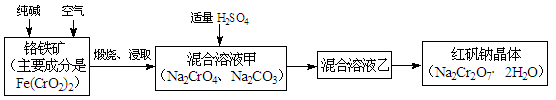 (1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。 (2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2。为了加快该反应的反应速率,可采取的措施是 。(写一种即可) (3)已知CrO42-在不同的酸性溶液中有不同的反应,如: 2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O ① 往混合溶液甲中加入硫酸必须适量的原因是 。 ② 混合溶液乙中溶质的化学式是 。 (4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。(5)请配平碱性溶液还原法中发生的离子反应: □Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH- |
参考解答
| (15分)(1)FeO·Cr2O3(2分) (2)粉碎矿石、升高温度(2分) (3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。(2分) ② Na2Cr2O7和Na2SO4(2分) (4)c(CrO42-)2c(H+)2/c(Cr2O72-) (2分) 正向(2分) (5) 4 6 19 8 3 14 (3分) |
试题分析:(1)根据元素的化合价,把盐写成氧化物的形式,中间用·连接,Fe(CrO2)2中Fe为+2价,对应氧化物为FeO,Cr为+3价,对应氧化物为Cr2O3,所以Fe(CrO2)2的氧化物形式为FeO·Cr2O3; (2)考虑综合效益,加快反应速率,可以升高温度或把矿石粉碎; (3)① 加硫酸的目的是除去杂质碳酸钠,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物,所以加入硫酸必须适量; ②因为最终得到的晶体是Na2Cr2O7·2H2O,所以混合溶液乙中的溶质是Na2Cr2O7及Na2SO4; (4)根据化学平衡常数的表达式,Cr2O72-+H2O  2CrO42-+2H+平衡常数K=c(CrO42-)2c(H+)2/c(Cr2O72-) ;加水稀释,反应物、生成物的浓度均减小,但生成物的浓度幂之积减小的更多,平衡正向移动; 2CrO42-+2H+平衡常数K=c(CrO42-)2c(H+)2/c(Cr2O72-) ;加水稀释,反应物、生成物的浓度均减小,但生成物的浓度幂之积减小的更多,平衡正向移动;(5)根据得失电子守恒法配平方程式,Cr2O72-中Cr为+6价,产物Cr(OH)3中Cr为+3价;反应物中S元素的化合价为-2价,产物中S元素的化合价为+2价,Cr2O72-中Cr整体降6价,S整体升高8价,6、8的最小公倍数是24,所以6×4,Cr2O72-前的系数是4,Cr(OH)3前的系数是8;8×3,所以S2O32-前的系数是3,S2-前的系数是6,根据电荷守恒配平OH-的系数是14,观察法配平H2O的系数是19,所以答案是 4 6 19 8 3 14 。 |
相似问题
下列化学方程式中 不能用H++OH-=H2O表示的是A.KOH+HCl=KCl+H2OB.2NaOH
下列化学方程式中,不能用H++OH-=H2O表示的是A.KOH+HCl=KCl+H2OB.2NaOH+H2SO4=Na2SO4+2H2O C.Ba(OH)2+2HCl=BaCl2+2H2O D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
单质钛(Ti)的机械强度高 抗蚀能力强 有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)
单质钛(Ti)的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属钛,主要反应有:①FeTiO
能用离子方程式H+ + OH- = H2O表示的是A.Ba(OH)2溶液和H2SO4溶液混合B.Na
能用离子方程式H+ + OH- = H2O表示的是A.Ba(OH)2溶液和H2SO4溶液混合B.NaOH溶液和盐酸混合C.Cu(OH)2和稀H2SO4反应D.CO2通入NaOH溶液中
有一个未完成的离子方程式 +XO3-+6H+=3X2+3H2O。据此判断下列说法中正确
有一个未完成的离子方程式+XO3-+6H+=3X2+3H2O。据此判断下列说法中正确的是A.X可能是周期表中第二周期元素B.X元素的原子最外层上有7个电子C.X2是还原
下列各组反应 前者是氧化还原反应 后者是非氧化还原反应的是[ ]A.实验室制取氧气;实验室制
下列各组反应,前者是氧化还原反应,后者是非氧化还原反应的是[ ]A.实验室制取氧气;实验室制取氢气B.实验室制取CO2;二氧化碳通入石灰水中C.实验室












