原子序数依次增大的A B C D都是元素周期表中前20号元素 B C D同周期 A D同主族 且A的
| 原子序数依次增大的A、B、C、D都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍.D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水.根据以上信息,回答下列问题: (1)D的离子结构示意图是______,A和B形成的化合物中含有非极性共价键的是______,该物质的电子式是______. (2)加热时,D单质能跟B的最高价氧化物对应水化物的浓溶液发生氧化还原反应,生成两种盐,该氧化还原反应的离子方程式为______. (3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式______. |
参考解答
| “B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水”且B、C、D原子序数依次增大,可知C的最高价氧化物对应的水化物具有两性,即Al(OH)3,故C为Al;Al(OH)3只能和强碱反应,故B为Na;A的原子结构中最外层电子数是电子层数的3倍,A为氧;A、D同主族,D为硫.所以,A、B、C、D依次为O、Na、Al、S. (1)D为硫,最外层6个电子,容易得2个电子达稳定结构;A、B分别是O、Na,形成的化合物中含有非极性共价键的是过氧化钠,该物质中既有离子键又有非极性共价键. 故答案为: 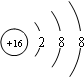 Na2O2 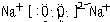 (2)D单质是S,B的最高价氧化物对应水化物是氢氧化钠,硫单质的化合价是0价,发生氧化还原反应时既做氧化剂又做还原剂,根据化合价变化规律,形成的离子分别是硫离子和亚硫酸根离子,故答案为:3S+6OH-
(3)C的最高价氧化物对应的水化物是Al(OH)3,B的最高价氧化物对应的水化物是氢氧化钠,氢氧化铝和氢氧化钠反应生成盐和水,氢氧化铝不溶于水,写化学式,故答案为:Al(OH)3+OH-=AlO2-+2H2O |
相似问题
下列化学反应的离子方程式不正确的是( )A.用饱和碳酸钠溶液吸收过量的二氧化碳:CO32-+CO2
下列化学反应的离子方程式不正确的是( )A.用饱和碳酸钠溶液吸收过量的二氧化碳:CO32-+CO2+H2O=2HCO3-B.Fe(OH)3溶于过量的HI溶液:2Fe(OH)3+6
下列反应的离子方程式书写正确的是( )A.氧化镁与稀硫酸反应:MgO+2H+=Mg2++H2OB.
下列反应的离子方程式书写正确的是( )A.氧化镁与稀硫酸反应:MgO+2H+=Mg2++H2OB.用醋酸除去水垢(主要成分CaCO3):CaCO3+2H+=Ca2++H2O+CO2↑C.
下列离子方程式正确的是( )A.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-B
下列离子方程式正确的是( )A.将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-B.少量CO2通入Ca(ClO)2溶液中:Cl-+CO2+H2O=HCO3-+HClOC.氯气与水
下列电离方程式一定错误的是( )A.NaHCO3=Na++H++CO32-B.NaHSO4=Na+
下列电离方程式一定错误的是( )A.NaHCO3=Na++H++CO32-B.NaHSO4=Na++H++SO42-C.H2SO4=2H++SO42-D.KCl=K++Cl-
按要求写出下列方程式:氯气通入氢氧化钠溶液______氯化铵和氢氧化钠共热______Al2(SO4
按要求写出下列方程式:氯气通入氢氧化钠溶液______氯化铵和氢氧化钠共热______Al2(SO4)3的电离方程式______.












