向一定量的Mg2+ NH4+ Al3+的混合液中加入Na2O2的量(横坐标)与生成沉淀和气体的量(纵
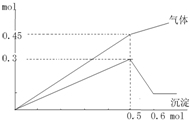
向一定量的Mg2+、NH4+、Al3+的混合液中加入Na2O2的量(横坐标)与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量浓度之比为( )
 |
参考解答
| 由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2+n[Al(OH)3=0.3mol,沉淀最小时,需要过氧化钠0.6mol-0.5mol=0.1mol,0.1molNa2O2与水反应生成0.2molNaOH,由反应Al(OH)3+NaOH=NaAlO2+2H2O可知,n[Al(OH)3=0.2mol,所以n[Mg(OH)2=0.3mol-0.2mol=0.1mol,根据镁元素可知原溶液中n(Mg2+)=n[Mg(OH)2=0.1mol,根据铝元素守恒可知n(Al3+)=n[Al(OH)3=0.2mol. 生成的气体为氨气与氧气,右图可知溶液加入0.05molNa2O2以后,再加Na2O2,气体的增加减少,故加入0.05molNa2O2时,NH4+完全反应,沉淀达最大值,故溶液中Mg2+、NH4+、Al3+都恰好完全反应,此时溶液中Mg2+、NH4+、Al3+为Na+代替,溶液中n(Na+)=2n(Na2O2)=2×0.5mol=1mol,根据电荷守恒有n(Na+)=2n(Mg2+)+n(NH4+)+3n(Al3+),即1mol=2×0.1mol+n(NH4+)+3×0.2mol,所以n(NH4+)=0.2mol. 所以溶液中三种离子的物质的量浓度之比为n(Mg2+):n(NH4+):n(Al3+)=0.1mol:0.2mol:0.2mol=1:2:2. 故选:B. |
相似问题
下列离子方程式中 正确的是( )A.NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2
下列离子方程式中,正确的是( )A.NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-B.高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C
下列能用H++OH-=H2O表示的化学反应是( )A.稀硫酸与氢氧化钡溶液反应B.稀盐酸与氢氧化钠
下列能用H++OH-=H2O表示的化学反应是( )A.稀硫酸与氢氧化钡溶液反应B.稀盐酸与氢氧化钠溶液反应C.稀盐酸与氢氧化铜反应D.稀硝酸与氢氧化镁反应
下列离子方程式中正确的是( )A.往苯酚溶液中通少量的CO2:C6H5O-+CO2+H2O→C6H
下列离子方程式中正确的是( )A.往苯酚溶液中通少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-B.水杨酸()与足量的Na2CO3溶液混合:C.向Ba(OH)2溶液
下列说法中正确的是( )A.用光亮洁净的铁丝蘸取某无色溶液 在无色灯焰上灼烧时观察到黄色火焰 则该
下列说法中正确的是( )A.用光亮洁净的铁丝蘸取某无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则该溶液中一定含Na+,一定不含K+B.酸、碱中和反应
下列离子方程式正确的是( )A.铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑B.铜片与氯化
下列离子方程式正确的是( )A.铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑B.铜片与氯化铁溶液反应:Cu+Fe3+═Cu2++Fe2+C.氢氧化镁溶于盐酸:Mg(OH)2+












