(15分)已知A B C D四种短周期元素 它们的核电荷数依次增大。A原子 C原子的L能层中 都有两
| (15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空: ⑴基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ; ⑵E2+离子的价层电子排布图是 ,F原子的电子排布式是 ; ⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 , B元素的气态氢化物的VSEPR模型为 ; ⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ; ⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ; ⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度: d= g/cm3。 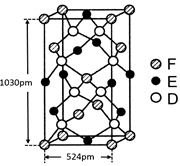 |
参考解答
⑴M 9个 ⑵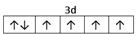 1s22s22p63s23p63d104s1 (或[Ar3d104s1) ; 1s22s22p63s23p63d104s1 (或[Ar3d104s1) ;⑶ sp2 ; 四面体 ;⑷ 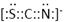 ; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)62↓ ; ; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)62↓ ;⑹CuFeS2 ; 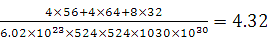 |
试题分析:根据题意可得A是C;B是N;C是O;D是S;E是Fe;F是Cu。⑴基态S原子核外电子排布是1s22s22p63s23p4,可见电子占据的最高能层是M层;在M能层有1个s轨道、3个p轨道、5个d轨道,一共具有的原子轨道数是9个。⑵Fe2+离子的价层电子排布图是 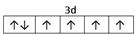 ;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为 ;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为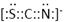 。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6 3+。配合物甲的化学式是K3[Fe(CN)6. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6.溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)62↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2 ;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度: 。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6 3+。配合物甲的化学式是K3[Fe(CN)6. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6.溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)62↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2 ;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度: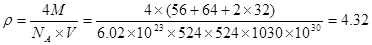 g/cm3。 g/cm3。 |
相似问题
短周期元素A B C D的原子序数依次增大 A C D的原子最外层电子数之和为10 A与D同主族 B
短周期元素A、B、C、D的原子序数依次增大,A、C、D的原子最外层电子数之和为10,A与D同主族,B原子的最外层电子数等于A原子的次外层电子数。下列叙述正确
X Y Z W是短周期元素 X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2/3;Z的
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2 3;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期
已知五种短周期元素的原子半径及主要化合价如下表:元素代号LMQRT原子半径/nm0.1600.143
已知五种短周期元素的原子半径及主要化合价如下表:元素代号LMQRT原子半径 nm0 1600 1430 1040 1110 066主要化合价+2+3+6、-2+2-2下列叙述正确的是
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是A.Z N两种元素的离子半径相比
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是A.Z、N两种元素的离子半径相比,前者较大B.X、N两种元素的气态氢化物的沸点相比
已知A B C D E是短周期中原子序数依次增大的5种元素 A在反应中既不容易得电子也不容易失电子
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族












