右图为实验室某浓盐酸试剂瓶上的标签 试根据有关数据回答下列问题:(1)该浓盐酸中HCl的物质的量浓度
右图为实验室某浓盐酸试剂瓶上的标签,试 根据有关数据回答下列问题: 根据有关数据回答下列问题: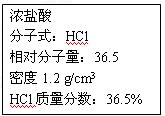 (1)该浓盐酸中HCl的物质的量浓度为 mol/L。 (2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。 A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目  D.溶液的密度 D.溶液的密度(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。 ①该学生需要量取 mL上述浓盐酸进行配制。 ②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。  A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶 B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀 C.将已冷却的盐酸沿玻璃棒注入500 mL的容量瓶中 D.将容量瓶的玻璃塞盖紧,颠倒摇匀 E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切 F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处 ③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。 A.用量筒量取浓盐酸时俯视观察凹液面 B.溶液注入容量瓶前没有恢复到室温就进行定容 C.定容时仰视刻度线 D.在配置前用已知浓度的稀盐酸润洗容量瓶 (4)现将200 mL 0.30 mol/L的盐酸与50 mL 0.80 mol/L CaCl2溶液混合(体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L;向所得混合溶液中加入5.3 g Na2CO3固体,充分反应后,溶液中生成沉淀的质量有_________g。 (5)在标准状况下,将______________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得盐酸的密度为1.2 g/cm3,溶质质量分数为36.5% 。(保留小数点后一位) |
参考解答
| (1)12(2分) (2)B D(2分) (3)①12.5(2分) ②B C A F E D(2分) ③B D(2分) (4)0.56(2分) 2.0 (2分) (5)352.8(2分) |
| 略 |
相似问题
向溴化钠溶液中通入过量氯气 反应后将溶液蒸干并灼烧 最后得到的固体物质是 溴化钠跟氯气反应的
向溴化钠溶液中通入过量氯气,反应后将溶液蒸干并灼烧,最后得到的固体物质是,溴化钠跟氯气反应的离子方程式是。
(12分)如图所示转化关系 判断A B C D各是什么物质 写出有关的化学方程式。(1)当A为气体单
(12分)如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式。(1)当A为气体单质时,A是___________,B是___________,C是___________
已知:①硫酸比氯酸稳定;②硫酸的酸性弱于高氯酸;③H2S比HCl易被氧化;④HCl 比H2S更容易
已知:①硫酸比氯酸稳定;②硫酸的酸性弱于高氯酸;③H2S比HCl易被氧化;④HCl 比H2S更容易由单质合成;⑤盐酸的酸性比H2S的酸性强。上述事实能够说明硫
下列叙述正确的是A.1个甘氨酸分子中存在9对共用电子B.PCl3和BCl3分子中所有原子的最外层都达
下列叙述正确的是A.1个甘氨酸分子中存在9对共用电子B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构C.H2S和CS2分子都是含极性键的极性分子D.
下列离子方程式书写正确的是( )A.次氯酸钙溶液中通入过量的CO2Ca2++2ClO-+H2O+
下列离子方程式书写正确的是()A.次氯酸钙溶液中通入过量的CO2Ca2++2ClO-+H2O+CO2====CaCO3↓+2HClOB.氢氧化钠溶液吸收氯气 2OH-+Cl2====Cl-+ClO-+H2












