(17分)H2O2是一种绿色氧化还原试剂 在化学研究中应用广泛。(1)某小组拟在同浓度Fe3+的催化
| (17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。 (1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol?L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器 ①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________ ②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。 ③设计实验装置,完成下图的装置示意图。 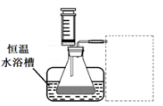 ④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。  (2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。 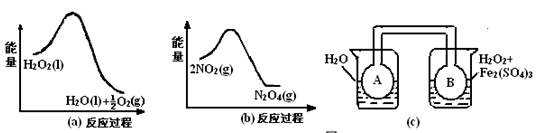 |
参考解答
(1)① ②生成相同体积的氧气所需的时间 ③ ④测定反应时间
 N2O4(g)也是放热反应,所以B瓶温度高于A瓶,温度升高,平衡逆向移动,二氧化氮浓度增大,颜色加深。 N2O4(g)也是放热反应,所以B瓶温度高于A瓶,温度升高,平衡逆向移动,二氧化氮浓度增大,颜色加深。 |
试题分析:(1)①过氧化氢在硫酸铁作催化剂条件下分解生成水和氧气,过氧化氢既作氧化剂又作还原剂,化学方程式及电子转移方向和数目为  ②反应速率是单位时间内物质浓度的改变量,所以测定不同浓度的过氧化氢对分解速率的影响,需测定相同时间内,产生氧气的体积的多少,或生成相同体积的氧气所需时间的多少; ③利用排水量气法,收集一定体积的O2,需要水槽、量筒、导气管,量筒内盛满水倒扣在水槽中,装置如图 ④
 N2O4(g)逆向进行,二氧化氮浓度增大,B瓶的颜色比A瓶的颜色深。 N2O4(g)逆向进行,二氧化氮浓度增大,B瓶的颜色比A瓶的颜色深。 |
相似问题
现有等物质的量的铜和银的混合物17.2克 与50.0mL的浓硝酸恰好完全反应 产生气体4.48L(标
现有等物质的量的铜和银的混合物17 2克,与50 0mL的浓硝酸恰好完全反应,产生气体4 48L(标准状况),则下列说法正确的是A.产生的气体是0 2molNO2B.硝酸
下列说法正确的是 [ ]A.氧化还原反应的本质是元素化合价的升降 B.氧化还原反应一定有氧元
下列说法正确的是 [ ]A.氧化还原反应的本质是元素化合价的升降 B.氧化还原反应一定有氧元素参加 C.氧化反应一定先于还原反应 D.发生氧化反应的
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O22PbO+2SO2;③制粗铅:PbO+CPb+CO↑;PbO+COPb+CO2。下列说法正确的是(
人体血红蛋白中含有Fe2+离子 如果误食亚硝酸盐 会使人中毒 因为亚硝酸盐会使Fe2+离子转变成Fe
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力.服用维
下列微粒不可能是硝酸的还原产物的是( )A.NOB.NO2C.NO3-D.NH4NO3
下列微粒不可能是硝酸的还原产物的是( )A.NOB.NO2C.NO3-D.NH4NO3












