某探究小组将一批电子废弃物简单处理后 得到含Cu Al Fe及少量Au Pt等金属的混合物 并设计如
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案: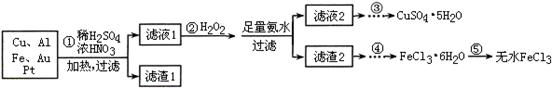 已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O 请回答下列问题: (1)步骤①Cu与酸反应的离子方程式为 。 (2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。 (3)步骤⑤不能直接加热脱水的理由是 。 (4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH = (已知:Ksp[Cu(OH)2]=2.0×10-20)。 (5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62- 某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。 四次平行实验耗去Na2S2O3标准溶液数据如下:
此产品中CuSO4·5H2O的质量分数为 。 |
参考解答
(1)Cu + 4H+ + 2NO3 ̄ = Cu2+ +2NO2↑+ 2H2O 3Cu+8H++2NO3 ̄ 3Cu2++2NO↑+4H2O (任写一个给2分) 3Cu2++2NO↑+4H2O (任写一个给2分)(2)将Fe2+氧化成Fe3+ (1分) Fe(OH)3、Al(OH)3 (各1分共2分) (3)FeCl3易水解:FeCl3+3H2O 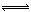 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分) Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)(4) 5 (2分) (5)溶液由蓝色褪为无色且半分钟内不恢复原色 (2分) 83.3% (2分) |
试题分析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H+ + 2NO3 ̄ = Cu2+ +2NO2↑+ 2H2O或3Cu+8H++2NO3 ̄  3Cu2++2NO↑+4H2O 3Cu2++2NO↑+4H2O(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。 (3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O 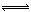 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(4)c2(OH ̄)?c(Cu2+)= Ksp[Cu(OH)2,代入数据可求出c(OH ̄)=1.0×10-9mol?L ̄1,pH=-lgc(H+)=-lg【Kw÷c(OH ̄)】=5。 (5)Cu2+把I ̄氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO4?5H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1 ×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3% |
相似问题
臭氧是一种强氧化剂 常用于消毒 灭菌等.(1)O3与KI溶液反应生成的两种单质是______和___
臭氧是一种强氧化剂,常用于消毒、灭菌等.(1)O3与KI溶液反应生成的两种单质是______和______.(填分子式)(2)O3在水中易分解,一定条件下,O3的浓
用高铁酸钠(Na2FeO4)对河水 湖水消毒 是城市饮用水消毒的新技术。已知制备高铁酸钠的
用高铁酸钠(Na2FeO4­)对河水、湖水消毒,是城市饮用水消毒的新技术。已知制备高铁酸钠的反应为Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是A.Na
制备氰氨基化钙的化学方程式如下:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑ 关于该反
制备氰氨基化钙的化学方程式如下:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,关于该反应的下列说法,正确的是( )A.氢元素被氧化,碳元素被还原B.HCN既是
铁及其化合物之间的相互转化可用下式表示:回答下列有关问题:(1)铁元素位于元素周期表的第四周期第Ⅷ族
铁及其化合物之间的相互转化可用下式表示:回答下列有关问题:(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原
在100mL混合酸的溶液中 硝酸的物质的量浓度为0.4mol/L 硫酸的物质的量浓度为0.2mol/
在100mL混合酸的溶液中,硝酸的物质的量浓度为0.4mol L,硫酸的物质的量浓度为0.2mol L,向其中加入6.4g铜粉,微热,使其充分反应,生成NO的物质的量A












