RO2受热分解为+4和+2价的混合氧化物 +4价的R能氧化浓盐酸生成Cl2 现将1mol RO2加热
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
|
参考解答
| B |
试题分析:根据题意,1 mol RO2最终生成RO,设氧化反应生成O2的物质的量为3a,则生成的Cl2的物质的量为2a,根据氧化还原反应得失电子守恒,可得2=3a×4+2a×2,解得a= 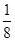 mol,则氧化Cl-的RO2的物质的量为 mol,则氧化Cl-的RO2的物质的量为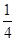 mol,即产物中+4价的R为 mol,即产物中+4价的R为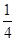 mol,综合四个选项,只有B符合要求。 mol,综合四个选项,只有B符合要求。 |
相似问题
在水溶液中 YO3n-和S2-发生如下反应:YO3n- + 3S2- +6H+ = Y-+ 3S↓+
在水溶液中,YO3n-和S2-发生如下反应:YO3n-+ 3S2- +6H+ = Y-+ 3S↓+ 3H2O,则YO3n-中Y元素的化合价和原子最外层电子数分别为A.+4、6B.+7、7C.+5、7D.+5、5
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑ 下列说法正确的
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是A.产物PH3分子中所有的原子可能共平面 B.该反应中P做还原剂,H2O做氧化
在SO2+2H2S = 2H2O+3S ↓ 反应中 氧化产物与还原产物的物质的量之比为A.2∶1
在SO2+2H2S=2H2O+3S ↓ 反应中,氧化产物与还原产物的物质的量之比为A.2∶1 B.1∶2 C.3∶1D.1∶3
(16分)某1L溶液中含有大量的Cl— Br— I— 若向1L该溶液中通入一定量的氯气 溶液中Cl—
(16分)某1L溶液中含有大量的Cl—、Br—、I—,若向1L该溶液中通入一定量的氯气,溶液中Cl—、Br—、I—的物质的量与通入的氯气的体积(标准状况)的量关
已知反应:3NO2+H2O═2HNO3+NO 回答下列问题:(1)该反应的离子方程式为
已知反应:3NO2+H2O═2HNO3+NO,回答下列问题:(1)该反应的离子方程式为.(2)氧化剂与还原剂的质量比为.(3)在标准状况下,3.36LNO2与H2O完全反应












