中学常见反应的化学方程式是A+B→X+Y+H2O(未配平 反应条件略去) 其中A B的物质的量之比为
| 中学常见反应的化学方程式是A+B→X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为1:4.请回答: (1)若Y是黄绿色气体,则Y的电子式是______,该反应的化学方程式是______. (2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是______. (3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中. ①A元素在周期表中的位置是______(填所在周期和族);Y的化学式是______. ②含a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______ mol. (4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是______. |
参考解答
(1)因黄绿色气体为氯气,氯原子最外层7个电子,则氯气中存在一对共用电子对,其电子式为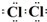 ,A、B的物质的量之比为1:4, 则反应为MnO2+4HCl(浓)
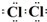 ;MnO2+4HCl(浓)
(2)A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,若为2个电子层,则第一层电子数为2,第二层电子数为4,其质子数等于电子数等于6,即A为碳元素,A、B的物质的量之比为1:4,则该反应为碳与浓硝酸反应,其反应为C+4HNO3═CO2↑+NO2↑+H2O,由化合价可知碳元素的化合价升高,则碳作还原剂,硝酸中氮元素的化合价降低,则硝酸作氧化剂,由化学计量数可知氧化剂与还原剂的物质的量之比为4:1,故答案为:4:1; (3)A为金属单质,常温下A在B的浓溶液中“钝化”,则A为铁或铝,B为浓硫酸或浓硝酸,又A可溶于X溶液中则A为铁,由A、B的物质的量之比为1:4,该反应为铁与稀硝酸反应生成硝酸铁、一氧化氮和水; ①铁为26号元素,在在元素周期表中的第4周期Ⅷ族,铁与稀硝酸反应生成的Y为NO,故答案为:第4周期Ⅷ族;NO; ②设被还原的硝酸铁的物质的量为x,则 2Fe3++Fe═3Fe2+, 2 3 x
由溶液中两种金属阳离子的物质的量恰好相等,则a-x=
(4)向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,则A中含有氯离子,B的焰色为黄色,则B中含有钠元素,A与B按物质的量之比1:4恰好反应,则该反应为氯化铝与氢氧化钠的反应,其反应为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,显然若A与B的物质的量分别为1mol、4mol,则钠离子4mol,氯离子3mol,偏绿酸根离子略小于1mol,因偏铝酸根离子水解则溶液显碱性,即c(OH-)>c(H+),则离子大小为c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+). |
相似问题
有以下6个反应(反应条件略):A.2Na+2H2O═2NaOH+H2↑ B.CH4+2O2═
有以下6个反应(反应条件略):A 2Na+2H2O═2NaOH+H2↑B.CH4+2O2═CO2+2H2O C.KClO3═2KCl+3O2↑D.CaCO3+2HCl═CaCl2+H2O+CO2↑E Na2O+CO2═Na2CO3F
下列药品置于空气中很容易变质(括号内的物质是变质后的物质) 其中不是因为氧化还原反应而变质的是(
下列药品置于空气中很容易变质(括号内的物质是变质后的物质),其中不是因为氧化还原反应而变质的是( )A.Na2SO3(Na2SO4)B.FeCl2(FeCl3)C.Na
下面是某研究性学习小组对离子方程式 xR2++yH++O2═mR3++nH2O的分析研究.在下面的各
下面是某研究性学习小组对离子方程式xR2++yH++O2═mR3++nH2O的分析研究.在下面的各种说法中错误的是( )A.可以根据电荷守恒,得出x与y的和一定等于
实验室常用浓HCl与MnO2的反应制取少量的氯气 其化学方程式为MnO2+4HCl=MnCl2+Cl
实验室常用浓HCl与MnO2的反应制取少量的氯气,其化学方程式为MnO2+4HCl=MnCl2+Cl2↑+2H2O取一定量的浓盐酸与二氧化锰发生反应,产生的氯气在标况下的体积
在Cu2S+2Cu2O △ . 6Cu+SO2↑反应中 说法正确的是( )A.Cu2S既是氧化
在Cu2S+2Cu2O△ 6Cu+SO2↑反应中,说法正确的是( )A.Cu2S既是氧化剂又是还原剂B.Cu是氧化产物C.氧化剂只有Cu2OD.生成1molCu,转移2mol电子












