FeCl3是一种用途比较广泛的盐.(1)印刷电路板是由高分子材料和铜箔复合而成.刻制印刷电路时 要用
| FeCl3是一种用途比较广泛的盐. (1)印刷电路板是由高分子材料和铜箔复合而成.刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的离子方程式______. (2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂.实验室制取氢氧化铁胶体的方法是______(填字母序号). A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可. B.在FeCl3溶液中加入足量的NaOH溶液 C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体 D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀 证明此胶体已经制成的最简单方法为______. (3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:2FeCl3+2KI=2FeCl2+I2+2KI 在上式上用双线桥法标出该反应电子转移的方向和数目______.向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为______色,再将混合液倒入______(填仪器名称)中,将两层液体分离. |
参考解答
| (1)FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2,该离子反应为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+; (2)FeCl3在沸水中可生成胶体,则应选C,且胶体具有丁达尔效应,可利用此性质来证明此胶体已经制成,故答案为:C;丁达尔效应; (3)2FeCl3+2KI=2FeCl2+I2+2KI中,Fe元素的化合价降低,I元素的化合价升高,则电子转移的方向和数目为 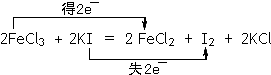 ;向反应后的溶液中加入CCl4溶液,有色层在下层,颜色为紫色(或紫红色),然后利用分液漏斗分离, 故答案为:  ;紫(或紫红);分液漏斗. |
相似问题
下列表述中 不合理的是( )A.有电子转移(得失或偏移)的化学反应都是氧化还原反应B.电解池是将电
下列表述中,不合理的是( )A.有电子转移(得失或偏移)的化学反应都是氧化还原反应B.电解池是将电能转变为化学能的装置C.胶体区别与其他分散系的
已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O 则M2O7x-中的M的化合价为(
已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为( )A.+2B.+3C.+4D.+6
原子X转移两个电子给Y 形成化合物XY 下列说法中正确的是( )A.X被氧化了B.X是氧化剂C.X
原子X转移两个电子给Y,形成化合物XY,下列说法中正确的是( )A.X被氧化了B.X是氧化剂C.X发生还原反应D.Y在反应中表现了还原性
下列反应中 水作为氧化剂的是( )A.NaOH+HCl=NaCl+H2OB.2Na+2H2O=2N
下列反应中,水作为氧化剂的是( )A.NaOH+HCl=NaCl+H2OB.2Na+2H2O=2NaOH+H2↑C.CaO+H2O=Ca(OH)2D.Cl2+H2O=HCl+HClO
下列叙述错误的是( )A.元素的单质可由氧化或还原含该元素的化合物来制得B.失电子越多的还原剂 其
下列叙述错误的是( )A.元素的单质可由氧化或还原含该元素的化合物来制得B.失电子越多的还原剂,其还原性就越强C.阳离子只能得到电子被还原,只能












