取一定物质的量浓度的NaOH溶液100mL 然后向其通入一定量的CO2气体 得到溶液A 向A中逐滴缓
| 取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加 HCl溶液的体积之间关系如图所示,下列有关说法不正确的是 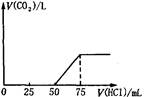
|
参考解答
| A |
CO2与NaOH溶液反应有如下两种“边界”情况: CO2+2NaOH=Na2CO3+H2O…① CO2+NaOH=NaHCO3…② 故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3; 当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的: Na2CO3+HCl=NaHCO3+NaCl…③ NaHCO3+HCl=NaCl+H2O+CO2↑…④ 并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等. 若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤ 设反应产生CO2之前消耗盐酸的体积为V1,从开始产生CO2至反应结束消耗盐酸的体积为V2. 将各种反应的情况总结如下表:
(1)V1=50mL,V2=75mL-50mL=25mL<V1,据此判断溶液中溶质的成分是Na2CO3和NaOH. 根据上面⑤③④三个化学方程式可知,NaOH和Na2CO3的物质的量之比等于消耗盐酸的体积之比,则 n(NaOH):n(Na2CO3)=(75mL-50mL):25mL=1:1. 故A不正确,B正确; (2)当加入盐酸75mL时,溶液溶质为NaCl,此时n(Na+)=n(HCl)=0.075mL×0.1mol·L-1=0.0075mol, 所以n(NaOH)=0.0075mol, c(NaOH)=0.0075mol/0.1L =0.075mol·L-1, 故C正确; (3)50mL~75mL发生的反应为HCO3-+H+=H2O+CO2↑,n(HCl)=0.025L×0.1mol·L-1=0.0025mol, 则V(CO2)=0.0025mol×22.4L·mol-1=0.056L=56mL, 故D正确。 选A。 |
相似问题
在一密闭容器中盛有2molNa2O2与2molNaHCO3 将其加热到150℃ 经充分反应后 容器内
在一密闭容器中盛有2molNa2O2与2molNaHCO3,将其加热到150℃,经充分反应后,容器内残留的固体是A.1molNa2CO3和2molNaOHB.2molNa2CO3和2molNaOHC.2molNa2CO3和1molNa2O2D.只有2molNa2CO3
有8gNa2O2 Na2O Na2CO3 NaOH的混合溶液与200g质量分数为3.65%的盐酸恰好
有8gNa2O2、Na2O、Na2CO3、NaOH的混合溶液与200g质量分数为3 65%的盐酸恰好完全反应,蒸干溶液,最终得固体质量为A.8gB.15 5gC.11 7gD.无法计算
将一小块钠投入下列溶液中 既能产生气体 又能生成白色沉淀的是A.稀硫酸B.氢氧化钠C.硫酸铜D.氯化
将一小块钠投入下列溶液中,既能产生气体,又能生成白色沉淀的是A.稀硫酸B.氢氧化钠C.硫酸铜D.氯化镁
能用来鉴别Na2CO3和NaHCO3两种白色固体的方法是 ( )A.分别取少量加入到石灰水中 观察
能用来鉴别Na2CO3和NaHCO3两种白色固体的方法是 ()A.分别取少量加入到石灰水中,观察有无沉淀生成B.分别取少量溶于水后,加入到入HCl溶液C.分别进
(13分)用脱脂棉包住约0.2g过氧化钠粉末 置于石棉网上 向脱脂棉上滴水 观察到脱脂棉剧烈燃烧起来
(13分)用脱脂棉包住约0 2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。(1)由上述实验现象所得到的有关过氧化钠跟水反应












