加热3.24 g碳酸钠和碳酸氢钠的混合物至质量不再变化 剩余固体的质量为2.51 g。计算原混合物中
| 加热3.24 g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为2.51 g。计算原混合物中碳酸钠的质量分数。 |
参考解答
| Na2CO3的质量分数为38.9%。 |
| 加热混合物时,由于碳酸氢钠分解,产生的二氧化碳和水蒸气从体系中排出,使反应混合物质量减少3.24 g-2.51 g='0.73' g,产生差量的有关物质是二氧化碳和水蒸气。 设混合物中碳酸氢钠的质量为x,则: 2NaHCO3  Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑2×84=168 18+44=62 x 0.73 g 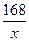 = =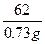 ,x=1.98 g。 ,x=1.98 g。碳酸钠的质量分数是: w(Na2CO3)= 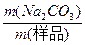 ×100% ×100%= 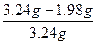 ×100%=38.9%。 ×100%=38.9%。 |
相似问题
可以用来鉴别Na2CO3溶液和NaHCO3溶液最好的是A.加CaCl2溶液B.加热C.加稀盐酸D.加
可以用来鉴别Na2CO3溶液和NaHCO3溶液最好的是A.加CaCl2溶液B.加热C.加稀盐酸D.加澄清的石灰水
关于锂 钠 钾 铷 铯的性质递变规律 不正确的叙述是A.单质的密度依次增大B.单质的熔沸点依次降低C
关于锂、钠、钾、铷、铯的性质递变规律,不正确的叙述是A.单质的密度依次增大B.单质的熔沸点依次降低C.单质的还原性依次增强D.离子的氧化性依次减弱
1.56 g某碱金属与足量盐酸反应 得到标准状况下的氢气448 mL 该金属的相对原子质量为(
1 56 g某碱金属与足量盐酸反应,得到标准状况下的氢气448 mL,该金属的相对原子质量为()A.85B.24C.39D.7
在甲 乙两坩埚中分别盛有等质量的NaHCO3固体 将甲坩埚充分加热后冷却 再加入足量的盐酸 乙不经加
在甲、乙两坩埚中分别盛有等质量的NaHCO3固体,将甲坩埚充分加热后冷却,再加入足量的盐酸,乙不经加热也加入足量盐酸,反应完全后,甲、乙两坩埚中实际
在饱和Na2CO3溶液中通入二氧化碳会有晶体析出 在饱和NaCl溶液中通入CO2则不发生化学反应。若
在饱和Na2CO3溶液中通入二氧化碳会有晶体析出,在饱和NaCl溶液中通入CO2则不发生化学反应。若在饱和NaCl溶液中通入氨气后,再通入CO2则会有晶体析出,简述其












