工业生产纯碱的工艺流程示意图如下:完成下列填空:(1)粗盐水加入沉淀剂A B除杂质(沉淀剂A来源于石
工业生产纯碱的工艺流程示意图如下: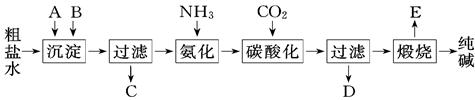 完成下列填空: (1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式A. ,B. (2)实验室提纯粗盐的实验操作依次为:取样、 、沉淀、 、 、冷却结晶、 、烘干 (3)工业生产纯碱工艺流程中,碳酸化时产生的现象是 .碳酸化时没有析出碳酸钠晶体,其原因是 (4)碳酸化后过滤、滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法是 (5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨.加石灰水后所发生的反应的离子方式程为 ,滤液D加石灰水前先要加热,原因是 (6)产品纯碱中含有碳酸氢钠.如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为 (注明你的表达式中所用的有关符号的含义) |
参考解答
| (1)Ca(OH)2或CaO Na2CO3 (2)溶解 过滤 蒸发 过滤 (3)有晶体析出(或出现浑浊) 碳酸钠溶解度比碳酸氢钠大 (4)NH4Cl 取样,加硝酸酸化,再加入硝酸银溶液,有白色沉淀产生,证明该阴离子是氯离子 (5)NH4++OH-=NH3↑+H2O 防止加石灰水时产生碳酸钙沉淀 (6)w(NaHCO3)= 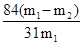 (设加热前质量为m1,加热后m2 ) (设加热前质量为m1,加热后m2 ) |
试题分析:(1)粗盐水中含有Mg2+ 、Ca2+ 、用Ca(OH)2或CaO将Mg2+ 转化为Mg(OH)2 ,再用Na2CO3将Ca2+ 转化为CaCO3沉淀,答案:Ca(OH)2或CaO Na2CO3 ⑵实验室提纯粗盐的整个操作过程为:取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘干几步;答案为:溶解 过滤 蒸发 过滤 (3)纯碱生产中碳酸化时,会看到溶液中析出晶体,这是由于碳酸钠的溶解度大于碳酸氢钠,故答案为:碳酸钠溶解度比碳酸氢钠大; (4)根据操作过程,氨化后通入二氧化碳的溶液发生复分解反应:H2O+CO2+NH3+NaCl=NaHCO3+NH4Cl,最终得到NH4Cl还有NaHCO3等,碳酸氢钠溶解度很小而结晶,故酸化后滤液的主要成分为:NH4Cl;检验其中的Cl―离子时,要经过取样,加硝酸酸化,加硝酸银,有白色沉淀,该阴离子是氯离子,答案:NH4Cl 取样,加硝酸酸化,再加入硝酸银溶液,有白色沉淀产生,证明该阴离子是氯离子。 (5)滤液中主要含有的是氯化铵,其和石灰水反应时:NH4++OH-  NH3↑+H2O,滤液D加石灰水前先要加热,原因是防止加石灰水时产生碳酸钙沉淀,答案为:NH4++OH- NH3↑+H2O,滤液D加石灰水前先要加热,原因是防止加石灰水时产生碳酸钙沉淀,答案为:NH4++OH- NH3↑+H2O,防止加石灰水时产生碳酸钙沉淀 NH3↑+H2O,防止加石灰水时产生碳酸钙沉淀(6)假设加热前纯碱的质量为m1,加热后的质量为m2,则加热损失的质量为:m1-m2,则纯碱中碳酸氢钠的质量为: 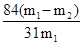 ;故纯碱中含有的碳酸氢钠的质量分数为= ;故纯碱中含有的碳酸氢钠的质量分数为=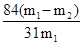 ,答案为:w(NaHCO3)= ,答案为:w(NaHCO3)=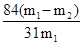 (设加热前质量为m1,加热后m2 ) (设加热前质量为m1,加热后m2 ) |
相似问题
关于Na2CO3 NaHCO3性质的有关叙述不正确的是A.热稳定性:Na2CO3>NaHCO3B.N
关于Na2CO3、NaHCO3性质的有关叙述不正确的是A.热稳定性:Na2CO3>NaHCO3B.NaHCO3能与NaOH溶液反应而Na2CO3则不能C.Na2CO3能转化成NaHCO3,而NaHCO3也
将Na2O2逐渐加入到含有Al3+ Mg2+ NH4+的混合液中并微热 产生沉淀和气体的物质的量与加
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、N
将a molNa2O2和b mol NaHCO3固体混合后 在密闭容器中加热到250OC 让其充分反
将a molNa2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250OC,让其充分反应。当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,a/b值可能为A.0.5B.0.25C.0.85D.1.0
将一小块钠投入盛50mL澄清饱和石灰水的烧杯里 不可能观察到的现象是( )A.钠熔成小球并在液面上
将一小块钠投入盛50mL澄清饱和石灰水的烧杯里,不可能观察到的现象是( )A.钠熔成小球并在液面上游动B.有气体生成C.溶液底部有银白色物质生成D.
如图所示 在蒸发皿中放一小块钠 加热至熔化时 用玻璃棒蘸取少量无水CuSO4与熔化的钠接触 瞬间产生
如图所示,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。据此判断下列说法












