甲 乙两个探究性学习小组 他们拟测定过氧化钠样品(含少量的Na2O)的纯度。(1)甲组同学拟选用图1
甲、乙两个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。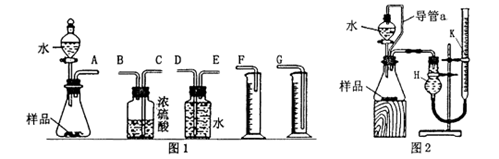 (1)甲组同学拟选用图1实验装置完成实验: ①写出实验中所发生反应的化学方程式_______; ②该组同学必须选用的装置的连接顺序是: A接( ),( )接( ),( )接( )(填接口字母,可不填满); (2) 乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气, 也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。 ①装置中导管a的作用是:_______。 ②实验结束后,在读取量气管k中液面读数时,你认为最合理的顺序是_______(用A、 B、C字母表示) A. 视线与量气管k中凹液面的最低点相平 B. 等待实验装置冷却 C. 上下移动量气管k,使k中液面与H中的液面相平 ③若实验中样品的质量为wg,实验前后量气管k中液面读数分别为V1、V2(换算成标 况)。则样品的纯度为 _______ (含w、V的表达式)。 (3)图2的装置也可测定一定质量铝镁合金(不含其它元素)样品中铝的质量分数。分液漏斗中加入的试剂是_______,能否加入氢氧化钠溶液 _______ (填“能”或“不能”),说明理由______________。 |
参考解答
| (11分)(1)① Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑(2分); ②EDG (1分) (2)①可以使分液漏斗内气体的压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利流下,消除由于加入水引起的氧气体积误差(2分) ②BCA (1分) ③Na2O2%=195×(V1-V2)/28w×100%(2分); (3)H2SO4(答案合理均可) (1分),不能(1分) , 若盛装碱液将会使分液漏斗旋塞粘住,造成分液漏斗损坏 (1分) |
试题分析:(1)① Na2O2、Na2O都能与水反应,方程式为Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑。 ②O2是不溶于水的气体,通过排水法测得生成气体的体积,故A接E,E接D,D接G。 (2) ①因为反应过程中有气体生成,要保持压强里外相等,故装置中导管a的作用是可以使分液漏斗内气体的压强与锥形瓶内气体压强相等,打开分液漏斗旋塞时水能顺利流下,消除由于加入水引起的氧气体积误差。 ②反应是放热反应,首先要等到实验装置冷却后在操作,待装置冷却后,就要上下移动量气管k,使k中液面与H中的液面相平,读数时视线与量气管k中凹液面的最低点相平,故最合理的顺序是BCA。 ③反应产生的气体为O2,反应为2Na2O2+2H2O=4NaOH+O2↑。通过化学方程式的计算得样品的纯度为Na2O2%=195×(V1-V2)/28w×100%。 (3) 铝镁合金中,可以选择H2SO4试剂,但不能用氢氧化钠溶液,因为若盛装碱液将会使分液漏斗旋塞粘住,造成分液漏斗损坏。 点评:本题主要考查学生金属钠的氧化物和过氧化物的性质以及用排水量气法测定气体的体积的方法,难度中等。 |
相似问题
有关纯碱和小苏打的叙述正确的是 ( )A.等质量的
有关纯碱和小苏打的叙述正确的是 ( )A.等质量的Na2CO3、NaHCO3分别与足量稀H2SO4反应,NaHCO3产生的CO2多B.等物质的量的Na2CO3、NaHCO3分别与足量
下列关于Na2O与Na2O2的说法中 不正确的是A.Na2O2比Na2O稳定B.均与水反应生成NaO
下列关于Na2O与Na2O2的说法中,不正确的是A.Na2O2比Na2O稳定B.均与水反应生成NaOH,因而均是碱性氧化物C.Na2O能被氧化成Na2O2D.均可与H2O、CO2反应
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实
化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验,请你参与并完成对有关问题的解答。图1图2(1)甲同学用图1
下列物质的保存方法正确的是:A.氢氧化钠溶液可盛放在带橡皮塞的玻璃瓶中B.氢氧化钠溶液可盛放在带玻璃
下列物质的保存方法正确的是:A.氢氧化钠溶液可盛放在带橡皮塞的玻璃瓶中B.氢氧化钠溶液可盛放在带玻璃塞的玻璃瓶中C.单质钠贮存在水中D.氢氧化钠可
向CuSO4溶液中加入下列物质①K ②Na ③Fe ④Ag 能置换出大量单质铜的是( )A.
向CuSO4溶液中加入下列物质①K、②Na、③Fe、④Ag,能置换出大量单质铜的是()A.①B.①②C.③④D.③












