(14分)某科研小组探究工业废Cu粉(杂质含有SiO2 Al2O3 Fe2O3中的一种或几种)的组成
| (14分)某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下: Ⅰ: 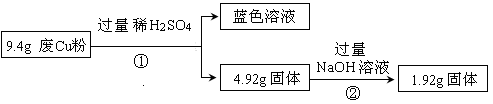 (1) 废Cu粉中一定含有的杂质是 。 (2) 分别写出过程①、②发生反应的离子方程式: ① ; ② 。 Ⅱ: 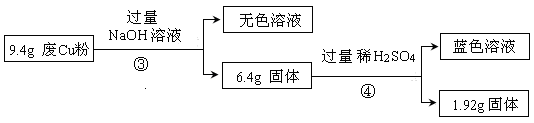 (3)综合过程Ⅰ、II,计算工业废Cu粉中各成分的质量之比是 (不必化简)。 Ⅲ:已知25℃时:
(5)下列与Ⅲ方案相关的叙述中,正确的是 (填字母)。 A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染 B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤 C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜 D.在pH>4的溶液中Fe3+一定不能大量存在 |
参考解答
| (1)Fe2O3 SiO2 (2分) (2)Fe2O3+6H+==2Fe3++3H2O 2Fe3++Cu==2Fe2++Cu2+ (2分) SiO2+2OH-==SiO32-+H2O (2分) (3)m (Cu)∶m(Fe2O3)∶m(SiO2)='3.2∶3.2∶3' (3分) (4)4.0≤pH<5.4 (2分) (5)ACD (3分) |
| (1) 废Cu粉中加入足量稀硫酸,仍然有固体剩余,说明含有二氧化硅,因为二氧化硅和硫酸不反应。所得溶于显蓝色,但铜和稀硫酸不反应,这说明一定含有氧化铁。氧化铁和硫酸反应生成硫酸铁,硫酸铁能溶解铜。 (2)根据(1)可知反应①的方程式为Fe2O3+6H+==2Fe3++3H2O、2Fe3++Cu==2Fe2++Cu2+ 。二氧化硅能和氢氧化钠溶液反应,方程式为SiO2+2OH-==SiO32-+H2O。 (3)根据反应②可知,二氧化硅的质量是4.92g-1.92g=3.00g。这说明在4.92g固体还含有为溶解的1.92g铜。根据反应③④可知,氧化铁和氧化铁反应的铜的质量共计是6.4g-1.92g=4.48g。根据方程式可知Fe2O3~Cu,所以二者的物质的量是4.48g÷224g/mol=0.02mol,所以铜的总的物质的量是0.02mol+1.92g÷64g/mol=0.05mol。因此原混合物中铜是0.05mol×64g/mol=3.2g,氧化铁是0.02mol×160g/mol=3.2g,所以工业废Cu粉中各成分的质量之比是m (Cu)∶m(Fe2O3)∶m(SiO2)=3.2∶3.2∶3。 (4)调节pH的目的是沉淀氢氧化铁,但不能沉淀氢氧化铜,所以根据沉淀的pH可知,范围应该是4.0≤pH<5.4。 (5)根据数据可知,如果要沉淀氢氧化亚铁,则氢氧化铜一定生成沉淀,所以选项B是错误的,其余都是正确的,答案选ACD。 |
相似问题
某KNO3溶液中含杂质KCl K2SO4和Ca(NO3)2 现欲除去杂质 得到纯净的KNO3溶液 则
某KNO3溶液中含杂质KCl、K2SO4和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是:A.Ba(NO3)2、K2CO3、AgNO3、HNO3B.K2CO3、Ba(N
下列有关除杂质(括号中为杂质)的操作中 错误的是:( )A.溴苯(溴):加氢氧化钠溶液 充分振荡
下列有关除杂质(括号中为杂质)的操作中,错误的是:()A.溴苯(溴):加氢氧化钠溶液,充分振荡,分液B.溴乙烷(乙醇):多次加水振荡,分液,弃水
除去括号内杂质所用试剂和方法不正确的是( )A.Fe (Al)——氢氧化钠溶液 过滤B.KNO3(N
除去括号内杂质所用试剂和方法不正确的是()A.Fe (Al)——氢氧化钠溶液,过滤B.KNO3(NaCl)——结晶C.水(NaCl)——蒸馏D.淀粉(泥沙)——渗析
下列除杂操作中正确的是( )A.除去溴乙烷中的少量Br2:加入NaOH溶液 加热 振荡 然后分液
下列除杂操作中正确的是()A.除去溴乙烷中的少量Br2:加入NaOH溶液,加热、振荡,然后分液得下层液体B.除去BaSO4中的少量BaCO3:加入过量稀盐酸,振荡
现有一瓶乙二醇和丙三醇的混合物 已知它们的性质如下表 据此 将乙二醇和丙三醇互相分离的最佳方法是(
现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是()A.萃取法 B.结晶法 C.分液法 D.蒸馏法












