现有部分短周期元素的性质或原子结构如下表:元素编号元素性质或原子结构T能形成双原子分子 原子间存在3
现有部分短周期元素的性质或原子结构如下表:
(2)X的最高价氧化物与烧碱反应的离子反应方程式为:______. (3)Z的非金属性比T元素强,用化学方程式表示:______. (4)XT是一种新型的无机材料,可由X的最高价氧化物与T的单质及焦炭反应生成,逸出的气体具有可燃性,写出反应方程式,并标出电子转移方向和数目.______. |
参考解答
| 由能形成双原子分子,原子间存在3对共用电子对知,T元素最外层5个电子,主族元素的族序数=其最外层电子数,T是氮元素; 由M层有3个电子知,其核外电子排布是2、8、3,故X是铝元素; 由最外层电子数是最内层电子数2倍,其最高氧化物是一种固体,用于生产光导纤维,光导纤维的主要是二氧化硅,所以Y是硅元素; 由最高正价为+7价,主族元素的族序数=其最外层电子数,且是短周期元素,氟没有正化合价,所以是氯元素. (1)Z是氯元素,最外层7个电子,容易得一个电子达到8电子稳定结构,离子结构示意图为 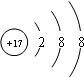 ,Y形成的最高价氧化物是二氧化硅,硅最外层4个电子,易形成4个共价键,故答案为:  ;4; (2)X的最高价氧化物是Al2O3,Al2O3是两性氧化物,既能和强酸反应又能和强碱反应生成盐和水, 故答案为:Al2O3+2OH-+3H2O═2[Al(OH)4-; (3)Z的非金属性比T元素强,判断非金属性的方法有:非金属间的置换反应,其最高价氧化物的水化物的酸性强弱,其气态氢化物的稳定性等, 故答案为:3Cl2+2NH3═N2+6HCl(或3Cl2+8NH3═N2+6NH4Cl); (4)由题意知,XT是AlN,X的最高价氧化物是Al2O3,根据元素守恒知,逸出具有可燃性的气体是CO,碳是还原剂,氮气是氧化剂,故答案为: 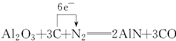 . |
相似问题
A B C D E F六种短周期主族元素 原子序数依次增大.其中B的单质在常温下为双原子分子 它与A
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与
下表中列出五种短周期元素A B C D E的信息 请推断后作答:元素有关信息A元素主要化合价为-2
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:元素有关信息A元素主要化合价为-2,原子半径为0 074nmB所在主族序数与所在周期序数之差为4
X Y Z都是第三周期元素 核电荷数依次增大 X的氧化物对应水化物强碱 Z的原子半径最小(稀有气体除
X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物强碱,Z的原子半径最小(稀有气体除外).据此判断下列说法不正确的是( )A.X是第
前四周期元素X Y Z W核电荷数依次增加 核电荷数之和为56;Y原子的M层p轨道有3个未成对电子;
前四周期元素X、Y、Z、W核电荷数依次增加,核电荷数之和为56;Y原子的M层p轨道有3个未成对电子;Z原子的M层p轨道有4个电子;W原子的L层电子数与最外层电
下列说法中错误的是( )A.日本福岛核电站泄露的53131I与加碘盐中的53127I互为同位素B.
下列说法中错误的是( )A.日本福岛核电站泄露的53131I与加碘盐中的53127I互为同位素B.单原子形成的离子,一定与稀有气体原子的核外电子排布相同C.












