有关元素A B C D E F的信息如下:元 素有关信息A最高价氧化物对应的水化物(甲)能与其气态氢
有关元素A、B、C、D、E、F的信息如下:
(1)写出物质甲与乙反应的离子方程式______ (2)下列说法不正确的是______(填序号). 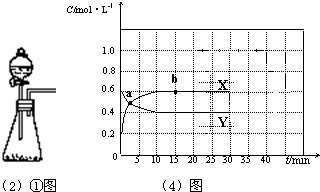 ①实验室可用右图所示装置制取B的最高价氧化物 ②用C单质做成的槽车,可用来运输甲的浓溶液 ③C和铜与稀硫酸组成的原电池,C电极被还原 (3)若用石墨做电极电解元素D、E组成的化合物饱和水溶液,写出电解反应的离子方程式为:______ (4)已知:2AO2(g)  A2O4(g);△H<0.在恒温恒容条件下,将一定量AO2和A2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示. ①该反应是由______开始反应的.(填“正反应”、“逆反应”、或“正逆反应同时”.) ②a、b两个点中,表示化学反应处于平衡状态的点是______. ③前10min内用AO2表示的化学反应速率v(AO2)=______mol?L-1?min-1. |
参考解答
| A最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐,说明生成的盐含有的元素全部为非金属元素,则应为N; B最外层电子数是次外层电子数的2倍,应为C元素; CM层上有3个电子,应为Al元素; D短周期原子半径最大的主族元素,应为Na元素; E最高正价与最低负价代数和为6,则最高正价为+7,应为Cl元素. (1)A最高价氧化物对应的水化物(甲)为HNO3,气态氢化物(乙)为NH3,二者反应的离子方程式为H++NH3=NH4+,故答案为:H++NH3=NH4+; (2)①B为C元素,对应的最高价氧化物为CO2,可用CaCO3和盐酸反应制备,反应不用加热,可用①图装置制备,故①正确; ②Al与冷的浓硝酸发生钝化反应,在表面生成一层致密的氧化物膜,阻碍反应的继续进行,所以可用Al制备的槽车运输浓硝酸,故②正确; ③Al和铜与稀硫酸组成的原电池中,Al较活泼,应作原电池的负极,被氧化,故③错误, 故答案为:③; (3)电解饱和NaCl溶液,生成NaOH、H2、Cl2,反应的离子方程式为2Cl-+2H2O=2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O=2OH-+H2↑+Cl2↑; (4)已知:2NO2(g)  N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中, ①反应为可逆反应,所加入的物质既有反应物,也有生成物,则正逆反应同时,故答案为:正逆反应同时; ②a、b两个点中,b点物质的浓度不再发生变化,应达到平衡状态,故答案为:b; ③化学反应中,物质的量浓度变化之比等于化学计量数之比,则X为NO2的变化曲线,Y为 N2O4的变化曲线, v(NO2)=
|
相似问题
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )元素代号LMXRT原子半径/nm
几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )元素代号LMXRT原子半径 nm0 1600 1430 1020 0890 074主要化合价﹢2﹢3﹢6、-2﹢2
某元素的质子数为16 有关该元素的推断正确的是( )A.非金属性比氯强B.最高价氧化物的水化物是一
某元素的质子数为16,有关该元素的推断正确的是( )A.非金属性比氯强B.最高价氧化物的水化物是一种强酸C.最高正价为+5,负价为-3D.处于元素周期
短周期的三种元素分别为X Y和Z 已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数
短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子电子
A B C代表三种短周期元素.已知A+和B-两种离子相差一个电子层 C元素核内质子数比B元素原子核内
A、B、C代表三种短周期元素.已知A+和B-两种离子相差一个电子层,C元素核内质子数比B元素原子核内质子数少9个,B和C两元素可以形成4核42个电子的负一价阴
A元素的最高价离子0.5mol被还原成中性原子时 要得到6.02×1023个电子 它的单质同盐酸充分
A元素的最高价离子0 5mol被还原成中性原子时,要得到6 02×1023个电子,它的单质同盐酸充分反应时,放出0 02gH2,用去0 4gA.B元素的原子核外电子层数与A












