氮元素可以形成多种化合物。回答以下问题:(1)基态氮原子的价电子排布式是______________
| 氮元素可以形成多种化合物。 回答以下问题: (1)基态氮原子的价电子排布式是__________________。 (2)C、N、O三种元素第一电离能从大到小的顺许昌是_________________。 (3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。 ①NH3分子的空间构型是____________;N2H4分子中氮原子轨道的杂化类型是____________________。 ②肼可用作火箭燃料,燃烧时发生的反应是: 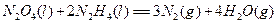 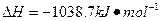 若该反应中有4mol N—H键断裂,则形成的 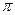 键有___________mol。 键有___________mol。③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号) a.离子键 b.共价键 c.配位键 d.范德华力 (4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物是别的是________________(填标号)。 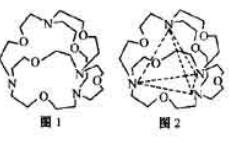 a.CF4 b. CH4 c. NH4+ d.H2O |
参考解答
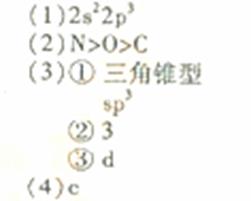 |
| 略 |
相似问题
科学家新发现的两种分子COS和C3O2(均为新型可燃性碳的化合物)的结构式分别为和 则下列有关说法正
科学家新发现的两种分子COS和C3O2(均为新型可燃性碳的化合物)的结构式分别为和,则下列有关说法正确的是()A.C3O2和COS在氧气中完全燃烧的产物均是CO
氯化硼的熔点为-107℃ 沸点为12.5℃ 在其分子中键与键之间的夹角为120o 它能水解 有关叙述
氯化硼的熔点为-107℃,沸点为12 5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是A.氯化硼液态时能导电而固态时不导电B.硼原子以s
PH3分子的空间构型是三角锥形而不是平而正三角形 最充分的理由是()A.PH3分子是极性分子B.PH
PH3分子的空间构型是三角锥形而不是平而正三角形,最充分的理由是()A.PH3分子是极性分子B.PH3分子内二个价键的键氏和键能均相等C.PH3分子内=个P-H键
下列叙述正确的是( )A.同主族金属的原子半径越大 金属的熔 沸点越高B.稀有气体原子序数越大
下列叙述正确的是( )A.同主族金属的原子半径越大,金属的熔、沸点越高B.稀有气体原子序数越大,单质沸点越高C.分子间作用力越弱,分子晶体的熔点越低
下列化合物的电子式正确的是( )A. H:ClB.[:Cl:]- Ca+2[:Cl:]-C. C
下列化合物的电子式正确的是()A. H:ClB.[:Cl:]- Ca+2[:Cl:]-C. Ca2+[:Cl:]2-D. H : O:O: H












