I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。请回答下列问题:①解释CO2为
| I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。 请回答下列问题: ①解释CO2为直线型分子的原因 ; ② PbCl2分子的立体构型为 ,该分子属于 分子(填“极性”或“非极性” ),其中Pb原子的杂化轨道类型为 。 II.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题: (1)铜原子基态电子排布式为 ; (2)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g/cm3,则铜晶胞的体积是 cm3,晶胞的质量是 克,阿伏伽德罗常数为 (列式计算,已知Ar(Cu)=63.6)。 |
参考解答
| I. (1) ①CO2属n+m=2,SP杂化,故为直线形 (每空2分) ②折线形(或V形) 极性分子 SP2 (每空1分) II.(1)1s22s22p63s23p63d104s1 (2)4.70×10-23 4.23×10-22 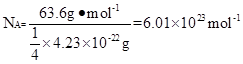 |
| I. (1)CO2中中心原子碳原子的孤对电子对数是(4-2×2)÷2=0,即碳原子是sp杂化,所以是直线型结构。 ②PbCl2中中心原子Pb原子的孤对电子对数是(4-1×2)÷2=1,即Pb原子是sp2杂化,所以是V型结构。 II.(1)根据构造原理可知,基态铜原子的电子排布式为1s22s22p63s23p63d104s1 。 (2)边长是361pm,所以体积是 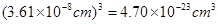 。根据密度可知晶胞的质量是 。根据密度可知晶胞的质量是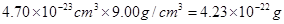 。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有 。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有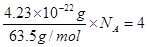 ,因此 ,因此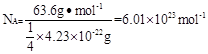 。 。 |
相似问题
下列关于各配合物的稳定性 判断不正确的是A.[Fe(CN)6]3->[Fe(SCN)6] 3-B.[
下列关于各配合物的稳定性,判断不正确的是A.[Fe(CN)6]3->[Fe(SCN)6] 3-B.[HgCl4] 2-> [HgF4] 2-C.[AlF6] 3->[AlBr6] 3-D.[Cu(NH3) 4]2+>[Zn(NH3) 4]2+
下列性质符合分子晶体的是: A.熔点1070℃ 易溶于水 水溶液能导电B.熔点是10.31℃ 液
下列性质符合分子晶体的是:A.熔点1070℃,易溶于水,水溶液能导电B.熔点是10 31℃,液体不导电,水溶液能导电C.熔点97 81℃,质软,能导电,密度是0
下列说法中正确的是( )A.难失电子的原子 获得电子的能力一定强B.易得电子的原子所形成的简单
下列说法中正确的是( )A.难失电子的原子,获得电子的能力一定强B.易得电子的原子所形成的简单阴离子,其还原性一定强C.分子中键能越大,键
已知[Co(NH3)6]3+的立体结构如图 其中数字处的小圆圈表示NH3分子 且各相邻的NH3分子间
已知[Co(NH3)6]3+的立体结构如图,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+离子位于八面体的中心。若其中两个NH3被Cl-取代
据最新报道:纽约大学的科学家最近研制出有“双腿”且能在盘子里“散步”的分子机器人 它是由26个氨基酸
据最新报道:纽约大学的科学家最近研制出有“双腿”且能在盘子里“散步”的分子机器人,它是由26个氨基酸结合而成的多肽分子,下列说法中正确的是 A.这












