(15分)镁 钙 钾 溴 氟 硼等元素在每升海水中的含量都大于1 mg 属于海水中的常量元素。⑴镓
| (15分) 镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。 ⑴镓与硼同主族,写出镓元素原子的价电子排布式 。 ⑵钾、钙、镓的第一电离能从大到小的顺序是 。 ⑶比较氟化钠和溴化钠的熔点:氟化钠 溴化钠(填“<”或“>”),分析其原因是 。 ⑷举出两例说明锂与镁具有相似性:① 、② ,这种相似性称为 。 ⑸用价层电子对互斥理论推断BF3空间构型为 ,NF3分子中N原子的杂化轨道类型为 ;在NH3·BF3中接受孤对电子的原子是 。 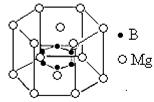 ⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为 。 |
参考解答
| (15分) ⑴4s24p1 (2分) ⑵钙>镓>钾(2分) ⑶>(1分) 由于两晶体的晶格能:氟化钠大于溴化钠。(1分) ⑷任选两个作答。★锂和镁在过量的氧气中燃烧均生成氧化物,而不是过氧化物。★锂、镁都能与氮气直接化合而生成氮化物。★锂、镁与水反应均较缓慢。★锂、镁的氢氧化物都是中强碱,溶解度都不大,在加热时分解为Li2O和MgO。★锂、镁的碳酸盐均难溶于水。(2分) 对角线规则(2分) ⑸平面正三角形 sp3 B (3分) ⑹MgB2 (2分) |
| 略 |
相似问题
分子晶体中如果只有范德华力 它的晶体一般采取密堆积结构 原因是分子晶体中( )A.范德华力无方
分子晶体中如果只有范德华力,它的晶体一般采取密堆积结构,原因是分子晶体中( )A.范德华力无方向性和饱和性B.占据晶格结点的粒子是原子C.化学键是共
2004年7月德俄两国化学家共同宣布 在高压下氮气会发生聚合得到高聚氮 这种高聚氮的N-N键的键能为
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ mol(N2分子中的键能为942kJ mol),晶体结构如
下列变化中 不存在化学键断裂的是
下列变化中,不存在化学键断裂的是()A.氯化氢气体溶于水B.干冰气化C.氯化钠固体溶于水D.氢气在氯气中燃烧
在超高压下 科学家用激光器将CO2加热到1800K 成功制得了类似石英的CO2原子晶体。下列关于CO
在超高压下,科学家用激光器将CO2加热到1800K,成功制得了类似石英的CO2原子晶体。下列关于CO2原子晶体的叙述中不正确的是A.晶体中C、O原子个数比为1∶2
某物质的晶体晶胞中含有A B C三种元素 其晶胞如图所示(其中前后两面面心中的B元素的原子未能画出)
某物质的晶体晶胞中含有A、B、C三种元素,其晶胞如图所示(其中前后两面面心中的B元素的原子未能画出)。晶体中A、B、C的原子个数比为A.1∶3∶1 B.2∶












