下列结构图中 ●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分) 小黑点代表未用于
下列结构图中,●代表前二周期元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。示例:F2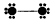 根据各图表示的结构特点,下列有关叙述正确的是 根据各图表示的结构特点,下列有关叙述正确的是 |
 |
| [ ] |
| A.上述结构图中共出现6种元素 B.甲、乙、丙为非极性分子,丁为极性分子 C.甲与丁可以发生化合反应生成离子化合物 D.向CaCl2溶液中加入(或通入)丙有白色沉淀产生 |
参考解答
| C |
相似问题
配位键常用A→B来表示 下列有关说法中正确的是 [ ]A.B原子所属元素一定是非金属元素 B
配位键常用A→B来表示,下列有关说法中正确的是 [ ]A B原子所属元素一定是非金属元素 B B的电负性一定大于A的电负性 C A原子可以提供接受孤对电子的
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下) 可由石墨剥离而成 具有极好的应用前景。
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是()A.石墨烯与石墨互为同位
0.01mol氯化铬(CrCl3?6H2O)在水溶液中用过量AgNO3处理 产生0.02mol Ag
0 01mol氯化铬(CrCl3?6H2O)在水溶液中用过量AgNO3处理,产生0 02molAgCl沉淀,此氯化铬最可能为( )A.[Cr(H2O)6]Cl3B.[Cr(H2O)5Cl]Cl2?H2OC
只有阳离子而没有阴离子的晶体是A.金属晶体B.原子晶体C.离子晶体D.分子晶体
只有阳离子而没有阴离子的晶体是A.金属晶体B.原子晶体C.离子晶体D.分子晶体
氨气分子空间构型是三角锥形 而甲烷是正四面体形 这是因为[ ]A.NH3中氮原子为sp2杂化
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为[ ]A.NH3中氮原子为sp2杂化,而CH4中碳原子是sp3杂化B.NH3中N原子形成三个杂化轨道,CH4中












