硼(B) 铝(Al) 镓(Ga)均属于硼族元素(第ⅢA族) 它们的化合物或单质都有重要用途。回答下列
| 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质 都有重要用途。回答下列问题: (1)写出基态镓原子的电子排布式 。 (2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更 高温度下Al2Cl6则离解生成A1Cl3单分子。 ①固体氯化铝的晶体类型是 ; ②写出Al2Cl6分子的结构式 ; 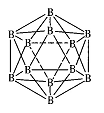 ③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。 ③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。(3)晶体硼的结构单元是正二十面体,每个单元中有12个硼原予(如图) 其中有两个原子为10 B,其余为11B,则该结构单元有 种不同的结构 类型。 (4)金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,计算确 定其晶胞的类型(简单、体心或面心立方) ;晶胞中距离最近的铝原 子可看作是接触的,列式计算铝的原子半径r(A1)= pm。 |
参考解答
| (1)1s2 2s22p6 3s2 3p6 3d10 4s2 4p1 或〔Ar〕3d10 4s2 4p1 (2)①分子晶体 ② 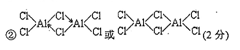 ③ 平面三角形 sp3 (3)3 (4)N(Al)×27/4053×10-30×6.02×1023=2.70,解得N(Al)=4.00,为面心立方晶胞 ×405pm/4=143pm. |
| (1)镓是31号元素,其原子核外有31个电子,根据构造原理知其核外电子排 布式1s2 2s22p6 3s2 3p6 3d10 4s2 4p1 或〔Ar〕3d10 4s2 4p1 (2)①分子晶体的熔沸点较低,氯化铝的熔沸点较低,所以为分子晶体。 ②铝原子和氯原子之间形成共价键,还形成一个配位键,其结构为 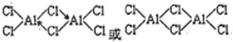 。 。③氯化铝中每个铝原子含有3个共价键,且不含孤电子对,为平面三角形结构, 缔合双分子Al2Cl6中Al原子的轨道杂化类型sp3。 (3)两个10B相邻、相间、相对,所以共有3种类型结构。 (4)每个晶胞中含有铝原子个数=ρV/M/NA=2.70×(405×10?10)3/17/NA==4.00, 该晶胞的每个顶点上和每个面上都含有一个Al原子,为面心立方晶胞,面心立 方晶胞中,每个面的对角线上三个原子紧挨着,所以对角线长度=21/2×405pm/4 =143pm。 |
相似问题
下列说法中 正确的是( )A.离子化合物中一定不含共价键 共价化合物中一定不含离子键B.水分子呈直
下列说法中,正确的是( )A.离子化合物中一定不含共价键,共价化合物中一定不含离子键B.水分子呈直线形,氨分子呈三角锥形C.碳原子之间可形成碳碳
氯化硼的熔点为-107℃ 沸点为12.5℃ 在其分子中键与键之间的夹角为120o 它能水解 有关叙述
氯化硼的熔点为-107℃,沸点为12 5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是[ ]A.氯化硼液态时能导电而固态时不导电 B.
下列物质属于分子晶体的是( ) A.熔点是1
下列物质属于分子晶体的是()A.熔点是1070℃,易溶于水,水溶液能导电B.熔点是10.31℃,液态不导电,水溶液能导电C.能溶于水,熔点812.8℃,沸点是
下列描述中正确的是 [ ]A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.
下列描述中正确的是 [ ]A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中有6对完全相同的成键电子对 D.SiF4和SO32-的中心原子均为sp3杂化
下列分子的空间构型呈正四面体的是[ ]A.CO2 B.NH3 C.C
下列分子的空间构型呈正四面体的是[ ]A.CO2 B.NH3 C.CCl4 D.CH2=CH2












