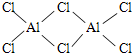
已知氯化铝的熔点为190℃(2.02×105Pa) 但它在180℃即开始升华.在500K和1.01×
已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华.在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况)为11.92g/L.有关氯化铝的叙述中错误的是( )
|
参考解答
| A.根据氯化铝熔点低及在180℃时开始升华,判断其为共价化合物,故A正确; B.500 K和1.01×105 Pa时,M=11.92 g?L-1×22.4 L?mol-1=267 g?mol-1,其化学式为Al2Cl6,故B正确; C.氯化铝的化学式应为Al2Cl6,分子中Al可提供空轨道,Cl可提供孤电子对,可形成配位键,故C正确; D.氯化铝是共价化合物,在熔融状态下不导电,故D错误. 故选D. |
相似问题
根据要求完成下列问题:(1)某元素原子共有6个价电子 其中一个价电子位于第四能层s轨道 试回答:该元
根据要求完成下列问题:(1)某元素原子共有6个价电子,其中一个价电子位于第四能层s轨道,试回答:该元素的原子结构示意图___________,价电子排布的轨道表
有关“物质和结构”研究方法的表述错误的是 [ ]A.价层电子对互斥理论不能预测所有分子的立体
有关“物质和结构”研究方法的表述错误的是 [ ]A.价层电子对互斥理论不能预测所有分子的立体结构 B.杂化轨道理论是鲍林为了解释分子的立体结构提出
向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液 再加入氨水 下列关于实验现象的叙述中不正确的是
向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,下列关于实验现象的叙述中不正确的是 [ ]A.先生成白色沉淀,加入足量氨水后沉淀消失 B.
下列各组中的物质或离子都含配位键的是( )A.H2O Al2Cl6B.CO2 SO42-C.PCl
下列各组中的物质或离子都含配位键的是( )A.H2O、Al2Cl6B.CO2、SO42-C.PCl5、[Co(NH3)4Cl2]ClD.NH4Cl、[Cu(NH3)4]SO4
氨气分子空间构型是三角锥形 而甲烷是正四面体形 这是因为 [ ]A.两种分子的中心原子杂化轨
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 [ ]A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 B.NH3分