二氧化硫和氮氧化物(NOx)对大气污染日趋严重 研究消除大气污染的方法是化学工作者的重要课题 目前有
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.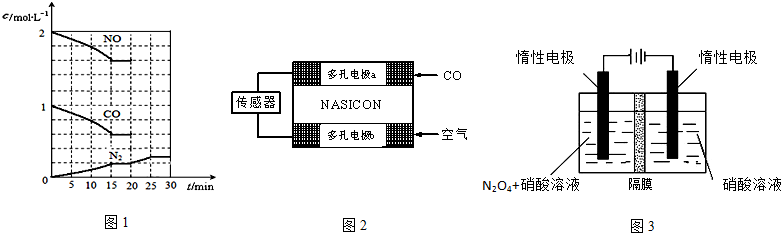 (1)可利用甲烷催化还原NOx的方法处理NOx,反应如下: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1 CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1 则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=______; (2)汽车尾气中的主要污染物有CO、NOx、碳氢化合物等,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应: 2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0. 生成无毒物质,减少汽车尾气污染.若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图1所示,则 ①前15s内的平均反应速率v (N2)=______(小数点保留3位); ②该反应平衡常数K=______(小数点保留3位); ③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将______移动(填“向左”、“向右”或“不”);20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,则改变的条件可能是______(填序号); a 加入催化剂 b 降低温度 c 缩小容器体积 d 增加CO2的量 ④该可逆反应△S______0(填“>”、“<”或“=”),在______(填“高温”、“低温”或“任何温度”)下能自发进行. (3)CO分析仪以燃料电池为工作原理,其装置如图2所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法错误的是______ A.负极的电极反应式为:CO+O2--2e-=CO2 B.工作时电极b作正极,O2-由电极a流向电极b C.工作时电子由电极a通过传感器流向电极b D.传感器中通过的电流越大,尾气中CO的含量越高 (4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现对SO2的处理目的.其中Fe3+的最外层电子排布式为______;SO2的VSEPR模型名称为______;与SO2互为等电子体的离子有______. (5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图3所示,N2O5在电解池的______(填“阳极”或“阴极”)区生成,其电极反应式为______. |
参考解答
| (1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1; ②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1; 依据盖斯定律计算①+②得到:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ/mol; 故答案为:△H=-867 kJ/mol; (2)①图象分析,前15分钟达到平衡时,氮气浓度增大为0.2mol/L,所以前15s内的平均反应速率v (N2)=
故答案为:0.013 mol/(L?s); ②依据图象分析,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为0.8mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L, 2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0; 平衡常数K=
③若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc=
故答案为:不移动;b; ④2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.反应可知△S<0; 依据△H-T△S<0是自发进行的反应;△H<0,△S<0,满足条件△H-T△S<0,应该在低温条件下进行可以自发进行, 故答案为:<;低温; (3)A.该装置是原电池,通入一氧化碳的电极a是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO+O2--2e-═CO2,故A正确; B.工作时电极b作正极,O2-由电极b流向电极a,故B错误; C.该装置是原电池,通入一氧化碳的电极a是负极,通入空气的电极是正极,原电池放电时,电子从负极a通过传感器流向电极b,故C正确; D.一氧化碳的含量越大,原电池放电时产生的电流越大,故D正确; 故答案为:B; (4)铁是26号元素,其核外有26个电子,失去三个电子后和铁离子最外层电子排布式:3s23p63d5;SO2中S原子的价层电子对为
故答案为:3s23p63d5;平面三角形;NO2-; (5)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,故答案为:阳极;N2O4-2e-+2HNO3=2N2O5+2H+. |
相似问题
(1) 2010年11月 日本东京大学的几原雄一教授在研究氢与钒(V)的化合物时捕捉到了氢原子 成功
(1) 2010年11月,日本东京大学的几原雄一教授在研究氢与钒(V)的化合物时捕捉到了氢原子,成功拍下 了世界首张氢原子的照片。如图所示是氢钒化合物的晶
下面有关晶体的叙述中 不正确的是( )A.金刚石为网状结构 由共价键形成的碳原子环中 最小的环上有
下面有关晶体的叙述中,不正确的是( )A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围距离相等
锌和铝都是活泼金属 其氢氧化物既能溶于强酸 又能溶于强碱。但是氢氧化铝不溶于氨水 而氢氧化锌能溶于氨
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。回答下列问
某物质的实验式为PtCl4·2NH3 其水溶液不导电 加入AgNO3溶液反应也不产生沉淀 以强碱处理
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 [ ]A.配
下列各组物质 化学键类型相同 晶体类型也相同的是 A.SO2和B.CCl4和KCl
下列各组物质,化学键类型相同、晶体类型也相同的是A.SO2和B.CCl4和KCl C.NaCl和HCl D.CO2和H2S












