(8分)右图是Na Cu Si H C N等元素单质的熔点高低的顺序 其中c d均是热和电的良导体。
(8分)右图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。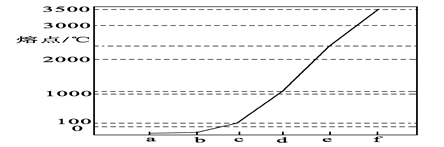 (1)单质a、f对应的元素以原子个数比1∶1形成的分子(相同条件下对H2的相对密度为13)中含________σ键和________个π键。 (2)a与b的元素形成的10电子中性分子X的空间构型为________;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为________,其中X与 Ag+之间以________键结合。 (3)右图是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个原因 。 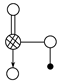 (4)氢键的形成对物质的性质具有一定的影响。 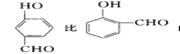 沸点 。(填高或低) 沸点 。(填高或低) |
参考解答
| (1) 3 2 (2)三角锥形(1分);[Ag(NH3)2+ 配位(2分) (3)HNO3是极性分子,易溶于极性的水中(1分);HNO3分子中的—OH易与水分子之间形成氢键(1分)(4)高 |
试题分析:根据Na、Cu、Si、H、C、N等元素单质的熔点由高到低的顺序排列的是C、Si、Cu、Na、N、H,即a是H2、b是N2、c是Na、d是Cu、e是Si、f是C。 (1)a、f对应的元素以原子个数比1∶1形成的分子即为乙炔分子,含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键。 (2)a与b的元素形成的10电子中性分子为NH3,空间构型为三角锥形;Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2+。 (3)该酸为HNO3,HNO3是极性分子,易溶于极性的水中;并且HNO3分子中的-OH易与水分子之间形成氢键,易溶于水。 (4)邻羟基苯甲醛在分子内形成氢键,在分子之间不存在氢键,间羟基苯甲醛不可能形成分子内氢键,只能在分子间形成氢键,因而,前者的沸点高于后者。 点评:考查电子排布、化学键、分子结构与性质,难度中等,旨在考查对知识的综合运用和掌握。 |
相似问题
在解释下列物质的性质变化规律与物质结构间的因果关系时 与键能无关的变化规律是A.与硅相比 金刚石的硬
在解释下列物质的性质变化规律与物质结构间的因果关系时,与键能无关的变化规律是A.与硅相比,金刚石的硬度大,熔点高B.HF、HCl、HBr、HI热稳定性依次减弱
下列分子中 杂化类型相同 空间构型也相同的是( )A.H2O SO2B.BeCl2 CO2C.H2
下列分子中,杂化类型相同,空间构型也相同的是( )A.H2O、SO2B.BeCl2、CO2C.H2O、NH3D.NH3、CH2O
研究表明生命起源于火山爆发 是因为火山爆发产生的气体中含有1%的羰基硫(COS) 已知羰基硫分子中所
研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法
基态原子的第5电子层只有2个电子 则该原子的第四电子层中的电子数肯定为 [ ]A.8个
基态原子的第5电子层只有2个电子,则该原子的第四电子层中的电子数肯定为 [ ]A.8个 B.18个 C.8~18个 D.8~32个
下列说法正确的是( )A.1个甘氨酸分子中存在9对共用电子B.PCl3和BCl3分子中所有原子的
下列说法正确的是()A.1个甘氨酸分子中存在9对共用电子B.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构C.H2(g)+Br2(g)=2HBr(g)△H=-72 kJ












