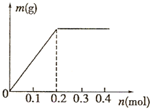
用Pt电极电解含有Cu2+和X3+均为0.1mol的溶液 阴极析出金属的质量m(g)与溶液中通过电子
用Pt电极电解含有Cu2+和X3+均为0.1mol的溶液,阴极析出金属的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图,则离子的氧化能力由大到小排列正确的是( )
 |
参考解答
| 通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol, 则氧化能力为Cu2+>X3+, 当电子超过0.2mol时,固体质量没变,说明这是阴极产生的是氢气,即电解水,说明氧化能力H+>X3+, 故氧化能力为Cu2+>H+>X3+. 故选D. |
相似问题
用石墨作电极 电解CuSO4溶液 一段时间后 阴极上只析出铜 要恢复到原浓度 应向溶液中加入 [
用石墨作电极,电解CuSO4溶液,一段时间后,阴极上只析出铜,要恢复到原浓度,应向溶液中加入 [ ]A.Cu(OH)2 B.Cu C.CuSO4 D.CuO
某课外化学兴趣小组设计了如图所示装置(虚框内部分未画出) 在装置内起初发生的反应为: Cu+H2
某课外化学兴趣小组设计了如图所示装置(虚框内部分未画出),在装置内起初发生的反应为: Cu+H2SO4===H2↑+CuSO4 (1)该装置的名称是________. (2)A
在同温同压下 用惰性电极在U型管中电解下列物质的水溶液 消耗相同的电量 生成气体的体积最大的是(
在同温同压下,用惰性电极在U型管中电解下列物质的水溶液,消耗相同的电量,生成气体的体积最大的是( )A.饱和食盐水B.CuCl2溶液C.CuSO4溶液D.NaOH溶液
常温下将两个铂电极插入200mLCuSO4溶液中进行电解 通电一定时间后 某一电极增重0.064g
常温下将两个铂电极插入200mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0 064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化).此
电浮选凝聚法是工业上采用的一种污水处理方法.图3 是电解污水的实验装置示意图 实验用污水中主要含有可
电浮选凝聚法是工业上采用的一种污水处理方法.图3 是电解污水的实验装置示意图,实验用污水中主要含有可被吸附的悬浮物(不导电)。下列有关推断明显不合












