反应:2SO2(g)+O2(g) 2SO3(g)(每生成2molSO3放出QKJ热量)。在相同温度
反应:2SO2(g)+O2(g) 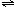 2SO3(g)(每生成2molSO3放出QKJ热量)。在相同温度条件下,向一密闭恒容容器中通入2molSO2和1 molO2达平衡时放出的热量为Q1,向另一容积相同的恒容密闭容器中通入1molSO2和0.5molO2达平衡时,放出的热量为Q2,则Q1、Q2满足的关系是( ) 2SO3(g)(每生成2molSO3放出QKJ热量)。在相同温度条件下,向一密闭恒容容器中通入2molSO2和1 molO2达平衡时放出的热量为Q1,向另一容积相同的恒容密闭容器中通入1molSO2和0.5molO2达平衡时,放出的热量为Q2,则Q1、Q2满足的关系是( )
|
参考解答
| B |
| 因为该反应是可逆反应,反应不可能进行到底,所以2molSO2不可能全部转化成2molSO3,那么Q1就应该小于Q。再分析第二次投放原料,如果保持的是压强不变,那么和第一次投放原料就成为等效平衡,放出热量就有Q2=Q1/2,但第二次投放保持的是体积不变,相当于减压,根据勒夏特列原理,平衡应该逆向移动,SO3产量小于第一次投放原料后SO3产量的一半,热量的放出也应该小于第一次的一半,Q2<Q1/2。答案选B |
相似问题
下列各组中的两种固态物质熔化或升华时 克服的微粒间相互作用力属于同种类型的是( )A.碘和氯化钾B
下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是()A.碘和氯化钾B.金刚石和硫酸钡C.二氧化硅和干冰D.固体酒精和冰醋酸
对于反应 2H2(g)+ O2(g) 2H2O(g);△H='-483.6' kJ/mol 下列
对于反应 2H2(g)+ O2(g) 2H2O(g);△H="-483 6" kJ mol,下列说法正确的是 A.反应物具有的总能量高于生成物B.H2的燃烧热△H=-241 8kJ mol,C.破坏H
已知热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH1=-483.6 kJ/mol
已知热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH1=-483 6 kJ mol,则对于热化学方程式:2H2O(l)===2H2(g)+O2(g) ΔH2=b,下列说法正确的是A.热化
市场上经常见锂离子电池 它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体) 电解质为一种能传导
市场上经常见锂离子电池,它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式
下列晶体熔化时 化学键没有破坏的是A.NaClB.干冰C.晶体硅D.石英
下列晶体熔化时,化学键没有破坏的是A.NaClB.干冰C.晶体硅D.石英












