化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的
| 化学键的键能是原子间形成1 mol化学键(或其逆过程)时释放(或吸收)的能量。以下是部分共价键键能的数据: H—S:364 kJ·mol-1,S—S:266 kJ·mol-1,S===O:522 kJ·mol-1, H—O:464 kJ·mol-1。 (1)试根据这些数据计算下面这个反应的反应热: 2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-Q kJ·mol-1,反应产物中的S实为S8,实际分子是8元环状分子( 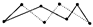 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。 提示:由8molS形成8mol S—S可推知平均1molS含有的S—S,然后计算),则Q=_________。(2)标准状况下,将a L H2S与b L SO2混合进行上述反应,当a>2b时,反应放热____________kJ·mol-1;当a<2b时,反应放热____________kJ·mol-1。 (3)又已知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1请写出(1)中反应若生成气态水时的热化学方程式 。 |
参考解答
| (1) 154 (2) 154b/22.4 154a/44.8 (3) 2H2S(g)+SO2(g)=3S(s)+2H2O(g) ΔH=-66 kJ·mol-1 |
| 反应热ΔH=反应物的键能之和—产物的键能之和 (1)ΔH=2×2×364+2×522—3×266—2×2×464=—Q,可知Q=154 (2)2H2S(g)+SO2(g)=3S(s)+2H2O(l) 当a>2b时,H2S过量,以SO2的量进行计算,反应放热为: 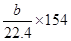 kJ·mol-1; kJ·mol-1;当a<2b时,SO2过量,以H2S的量进行计算,反应放热为: 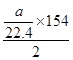 =154a/44.8kJ·mol-1; =154a/44.8kJ·mol-1;(3)反应①2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=-154 kJ·mol-1 反应②H2O(l)=H2O(g) ΔH=+44 kJ·mol-1 由盖斯定律①+2×②可知:2H2S(g)+SO2(g)=3S(s)+2H2O(g) ΔH=-66 kJ·mol-1 |
相似问题
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)? C(g)+D(s)的影响 进行了如下实验:恒
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)? C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol
下列化合物中 既有离子键又有共价键的是A.NH4ClB.MgOC.C2H6D.CO2
下列化合物中,既有离子键又有共价键的是A.NH4ClB.MgOC.C2H6D.CO2
下面对SO2和CO2的描述正确的是A.都是直线形结构B.中心原子都采取sp杂化C.S原子和C原子上都
下面对SO2和CO2的描述正确的是A.都是直线形结构B.中心原子都采取sp杂化C.S原子和C原子上都没有孤电子对D.SO2为V形结构,CO2为直线形结构
白磷和红磷是由磷元素形成的不同单质 它们燃烧的产物都是 P2O5 在相同条件下等质量的白磷和红磷燃烧
白磷和红磷是由磷元素形成的不同单质,它们燃烧的产物都是 P2O5,在相同条件下等质量的白磷和红磷燃烧时前者放出的热量多。下列说法正确的是A.白磷和红
下列说法正确的是A.在分子中 两个成键的原子间的距离叫做键长B.H—Cl的键能为431.8 kJ/m
下列说法正确的是A.在分子中,两个成键的原子间的距离叫做键长B.H—Cl的键能为431 8 kJ mol,H—I的键能为298 7 kJ mol,这可以说明HCl分子比HI分子












