a mol FeS与b mol FeO投入到VL c mol/L的硝酸溶液中充分反应 产生NO气体
a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为①(a+b)×189g ②Vc-(9a+b) mol ③(a+b)mol ④Vc-(9a+b)/3mol
|
参考解答
| A |
| 由元素守恒知:未被还原的硝酸将转化为Fe(NO3)3中的NO3—,所以显酸性的硝酸的物质的量等于Fe(NO3)3的物质的量的3倍,由元素守恒知,n〔Fe(NO3)3〕=n(Fe)=(a+b)mol,所以未被还原的硝酸的质量='3(a+b)' mol×63 g·mol-1='(a+b)×189' g,①正确; 又根据化合价升降守恒知 a mol 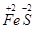 →a mol →a mol 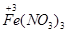 +a mol +a mol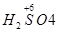 升高(3-2)a+(6+2)a='9a' mol 升高(3-2)a+(6+2)a='9a' molb mol 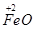 →b mol →b mol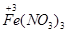 升高(3-2)b='b' mol 升高(3-2)b='b' molx mol 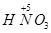 →x →x 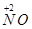 mol降低(5-2)x mol='3x' mol mol降低(5-2)x mol='3x' mol得9a mol+b mol=3xmol,即显氧化性的硝酸的物质的量x=(9a+b)/3mol,所以未被还原的硝酸为( 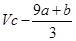 )mol,④正确 )mol,④正确 |
相似问题
(5分) (1)配平下列反应方程式并用双线桥标出电子转移的方向和数目 As2O3 +
(5分) (1)配平下列反应方程式并用双线桥标出电子转移的方向和数目As2O3 +HNO3 +H2O =H3AsO4 +NO↑(2)该反应中氧化剂是________,氧化产物是________
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价 氧化 1 mol
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气A.2molB.2 5molC.3molD.4mol
在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中 被氧化的氯元素与被还原的
在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为:A.1:1B.5:1C.1:5D.3:1
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O32-+2H2O,下列说法正确的是A.x=2B.Fe2+、S2O32-都是还原剂C.硫元素
(4分)已知离子反应:+6I—+6H+=R—+3I2+3H2O n=_____ R元素在中的化合价是
(4分)已知离子反应:+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在中的化合价是_____。












