为探索工业含铝 铁 铜合金废料的再利用 甲同学设计的实验方案如下:请回答:(1)操作①用到的玻璃仪器
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: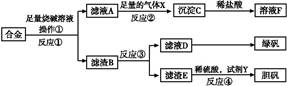 请回答: (1)操作①用到的玻璃仪器有 。 (2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。 (3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。 (4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。 (5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。 将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。 (6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。 |
参考解答
| (1)烧杯、漏斗、玻璃棒 (2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- (3)取少量滤液D加入NaOH溶液,产生白色沉淀,白色沉淀迅速变成灰绿色最后变成红褐色(合理即可) (4)Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O(或Cu+H2O2+H2SO4=CuSO4+2H2O) (5)铁粉与杂质铜形成原电池,加快了反应速率 因为氯化铁是强酸弱碱盐水解生成氢氧化铁和盐酸,加热蒸干时使HCl挥发造成水解平衡右移,因此得不到FeCl3·6H2O 晶体 (6)2 mol/L 4.8 g 4.48 |
(1)操作①是过滤。(2)金属中只有铝能和氢氧化钠溶液反应生成AlO2-, AlO2-和足量CO2生成Al(OH)3沉淀和HCO3-。(3)滤液D中含有Fe2+,可以利用其和碱生成沉淀时的颜色变化、自身不能使KSCN溶液变红而氧化后变红的性质进行检验。(4)H2O2是绿色氧化剂,还原产物是H2O。(5)里面有杂质铜,形成原电池,加快了反应速率;Fe3+很易发生水解。(6)滤渣B中含有Fe和Cu,分析实验①到②和②到③的过程可知:①到②时,金属过量,硝酸完全反应,100 mL HNO3共产生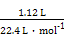 ='0.05' mol NO,消耗金属4.2 g,由反应: ='0.05' mol NO,消耗金属4.2 g,由反应:3Fe + 8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O 3×56 g 8 mol 2 mol 4.2 g 0.2 mol 0.05 mol 知:消耗的4.2 g金属恰好为Fe,且可推知①中消耗的也为Fe且质量为4.2 g,同时求得HNO3的浓度为: 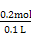 ='2' mol·L-1。又由反应: ='2' mol·L-1。又由反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 3×64 g 2 mol m(Cu) 0.05 mol 得:m(Cu)= 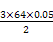 g='4.8' g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应: g='4.8' g可知:②到③中溶解的4.8 g金属恰好是Cu,即铜的总质量即为4.8 g;根据前面的分析可知:④与③相比多加的100 mL HNO3是与Fe2+反应:3Fe2+ + 4H+ + NO3-=3Fe3++NO↑+2H2O 3 mol 4 mol 1 mol 22.4 L 0.15 mol 0.2 mol0.2 mol V′ 即V′= 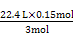 ='1.12' L。 ='1.12' L。故V=3.36+1.12=4.48。 |
相似问题
铜既不溶于稀硫酸 也不溶于NaNO3溶液 但可溶于其混合溶液。已知某200 mL的1 mol/L硫酸
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合溶液。已知某200 mL的1 mol L硫酸溶液中含有0 6 mol L NaNO3,理论上最多溶解Cu的质量是()A.19
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中 汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g)2CO2(g) +N2
下列叙述正确的是 [ ]A.有单质生成的分解反应一定是氧化还原反应 B.氧化还原反应的本质是
下列叙述正确的是 [ ]A.有单质生成的分解反应一定是氧化还原反应 B.氧化还原反应的本质是化合价发生变化 C.还原剂就是反应中被还原的物质 D.氧
下列有关氧化还原反应的说法正确的是( )A.阳离子只有氧化性 阴离子只有还原性B.失电子难的原子获
下列有关氧化还原反应的说法正确的是( )A.阳离子只有氧化性,阴离子只有还原性B.失电子难的原子获得电子的能力一定强C.氧化还原反应中的反应物,
(共12分)过氧化氢是重要的氧化剂 还原剂 它的水溶液又称为双氧水 常用作消毒 杀菌 漂白等。某化学
(共12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧












