采用两种方法制取铜 现有铁 氧化铜 稀硫酸三种物质及如图所示实验装置供选择.(1)第一种方法的实验过
| 采用两种方法制取铜,现有铁、氧化铜、稀硫酸三种物质及如图所示实验装置供选择. (1)第一种方法的实验过程中有蓝色溶液产生,应选用如图所示装置中的(填序号)______. (2)第二种方法应选用如图所示装置中的______. (3)在第一种方法制取的铜中,对于可能存在的杂质,可以加______除去;在第二种方法制取的铜中,可能存在的杂质是______. (4)若用这两种方法制得的铜的质量相等,下列叙述符合实际试验结果的是______. ①消耗氧化铜的质量相等 ②消耗铁的质量相等 ③消耗硫酸的质量相等 ④生成硫酸亚铁的质量不相等 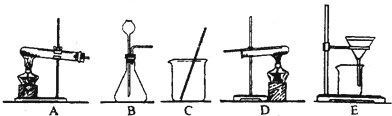 |
参考解答
| (1)用铁、氧化铜、稀硫酸三种物质制取铜,实验过程中有蓝色溶液产生,因此方法是将氧化铜与硫酸反应生成硫酸铜,然后将铁与硫酸铜反应置换出铜,采用过滤法即可得到铜.故选用的装置应为CE; (2)第二种方法是铁与稀硫酸反应生成氢气,氢气置换氧化铜中的铜.因此用到的装置还有B,固液常温下制取气体的装置,然后用氢气还原氧化铜,用到的装置是D (3)在第一种方法中铁与硫酸铜反应时由于生成的铜覆盖在铁的表面,制取的铜中可能会含有铁,铁与硫酸反应而铜不与硫酸反应,因此可加入硫酸除去铁.第二种方法中氢气还原氧化铜时氧化铜没完全反应,生成的铜中会混有氧化铜. (4)因为整个制备过程中,所有Cu元素都能形成单质Cu,而都来自CuO,没有损失,所以①②氧化铜质量相同. ①Fe+H2SO4=FeSO4+H2↑,H2+CuO
②CuO+H2SO4=CuSO4+H2O,CuSO4+Fe=Cu+FeSO4 生成1份Cu需要1份CuO和1份H2SO4和1份Fe 看上去都是相同的.特别注意用H2还原氧化铜的时候,需要先通H2然后加热,以将空气从玻璃管中排出.如果不排出,会引起爆炸,所以H2的量要多一些.自然H2SO4和铁的量也要多一些,同时生成的硫酸亚铁质量可能不同. 故选①④. 故答案为:(1)CE (2)BD (3)稀硫酸 氧化铜(4)①④ |
相似问题
符合下列物质变化要求的甲物质是( )A.CuB.Na20C.MgD.CuO
符合下列物质变化要求的甲物质是( )A.CuB.Na20C.MgD.CuO
某些科学家对3个互相联系的化学反应:①3FeCl2+4H2OFe3O4+6HCl+H2 ②Fe3O4
某些科学家对3个互相联系的化学反应:①3FeCl2+4H2OFe3O4+6HCl+H2,②Fe3O4+Cl2+6HClFeCl3+3H2O+O2,③3FeCl3=3FeCl2+Cl2很感兴趣,他们想利用这三个反应
某化工厂按如下步骤生产:(1)以煤为燃料煅烧石灰石;(2)用饱和碳酸钠溶液充分吸收步骤(1)中产生的
某化工厂按如下步骤生产:(1)以煤为燃料煅烧石灰石;(2)用饱和碳酸钠溶液充分吸收步骤(1)中产生的二氧化碳;(3)使步骤(1)产生的氧化钙跟水反应
如图表示单质A所能发生的一系列变化.其中B D为红色固体;E为黑色固体.请回答下列问题:(1)请写出
如图表示单质A所能发生的一系列变化.其中B、D为红色固体;E为黑色固体.请回答下列问题:(1)请写出下列物质的化学式:A______、E______.(2)写出下
下列物质的转变 不能一步实现的是( )A.CuO→Cu(OH)2B.K2SO4→KOHC.FeCl
下列物质的转变,不能一步实现的是( )A.CuO→Cu(OH)2B.K2SO4→KOHC.FeCl3→Fe(NO3)3D.CaCO3→CaCl2












