某体系中存在如下反应:① ②(1)反应①中H2S作_______剂 反应②属于_____
| 某体系中存在如下反应: ① 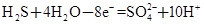 ② ②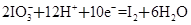 (1)反应①中H2S作_______剂,反应②属于_______反应。(填“氧化”或“还原”) (2)若在反应①中失去0.2 mol电子,则反应②中可生成_______g碘。 (3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:______。 (4)由上述反应可推知_______。 a.氧化性:K2SO4>KIO3 b.酸性:HIO3>H2SO4 c.还原性:H2S>I2 d.反应过程中溶液的酸性逐渐减弱 |
参考解答
(1)还原 还原 (2)5.08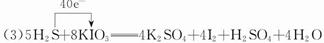 (4)c |
| (1)反应①中S元素化合价升高,是氧化反应,H2S作还原剂。反应②中I元素化合价降低,是还原反应。 (2)氧化还原反应中得失电子数相等,反应①中失去0.2 mol 电子,反应②中必然得到0.2 mol电子,生成碘0.02 mol,质量为5.08 g。 (3)调整化学计量数使两个方程式得失电子数相等,将两个方程式相加,电子由S转移到I,电子转移数为40。 (4)根据氧化剂的氧化性大于氧化产物的氧化性知氧化性KIO3>K2SO4,同理,还原性H2S>I2,反应过程中有H2SO4生成,酸性逐渐增强,根据该反应无法比较HIO3、H2SO4的酸性,故只有c正确 |
相似问题
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。反应原理为: C3N3(OH)33HNC
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。反应原理为: C3N3(OH)33HNCO; 8HNCO+6NO27N2+8CO2+4H2O,下列说法正确的是:()A.C3N3(OH
葡萄糖与下列物质在一定条件下反应时 葡萄糖作还原剂的是A.乙酸溶液B.银氨溶液C.氢气D.金属钠
葡萄糖与下列物质在一定条件下反应时,葡萄糖作还原剂的是A.乙酸溶液B.银氨溶液C.氢气D.金属钠
铋(Bi)位于元素周期表中VA族 其价态为+3时较稳定 铋酸钠(NaBiO3)可氧化硫酸锰(MnSO
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++N
在一定条件下 RO与R-可发生反应:RO3—+5R-+6H+===3R2+3H2O 下列关于R元素的
在一定条件下,RO与R-可发生反应:RO3—+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是A.元素R位于周期表中第ⅤA族 B.RO3—中的R只能被
赤铜矿的主要成分是Cu2O 辉铜矿的主要成分是Cu2S 将赤铜矿与辉铜矿混合加热有如下反应:Cu2S
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O=6Cu+SO2↑ 下列关于该反应的说法正确的是A.Cu2S












