(6分)稀硝酸和足量的铁反应的化学方程式如下:3Fe + 8HNO3 = 3Fe(NO3)2+ 2N
| (6分)稀硝酸和足量的铁反应的化学方程式如下: 3Fe + 8HNO3 = 3Fe(NO3)2+ 2NO↑+ 4H2O (1)该氧化还原反应的氧化剂是 ,氧化产物是 。 (2)请用双线桥法表示出电子转移的方向和数目: 3Fe +8HNO3 = 3Fe(NO3)2+2NO↑+4H2O (3)若生成标准状况下11.2LNO气体,反应中被还原的HNO3的物质的量为________。 |
参考解答
| (共6分) (1)HNO3; Fe(NO3)2 (各1分) (2) 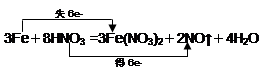 (2分) (2分) (3)0.5 mol (2分) |
试题分析:(1)根据反应放热化学方程式可知,铁元素的化合价从0价升高到+2价,失去2个电子;硝酸中氮元素的化合价从+5价降低到+2价,得到3个电子,所以硝酸是氧化剂,硝酸亚铁是氧化产物。 (2)根据电子的得失守恒可知,用双线桥法表示出电子转移的方向和数目为 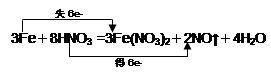 (3)硝酸的还原产物是NO,物质的量是11.2L÷22.4L/mol=0.5mol,所以根据氮原子守恒可知,被还原的硝酸的物质的量是0.5mol。 点评:本题是高考中的常见考点之一,试题难易适中,侧重能力的考查。氧化还原反应判断的关键是准确标出有关元素的化合价变化情况,然后根据有关概念判断即可。而氧化还原反应的计算,则一般利用电子的得失守恒进行。 |
相似问题
工业上冶炼金属钼的化学原理为:①2MoS2+7O22MoO3+4SO2;②MoO3+2NH3·H2O
工业上冶炼金属钼的化学原理为:①2MoS2+7O22MoO3+4SO2;②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;④H2MoO4MoO3
下列过程或事实不涉及氧化还原反应的是①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇
下列过程或事实不涉及氧化还原反应的是①蔗糖炭化②用氢氟酸雕刻玻璃③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞⑤雷雨发庄稼⑥浓硝酸常显黄色A.
三氟化氮(NF3)是无色无味气体 它可由氨气和氟气反应制得:4NH3+3F2===NF3+3NH4F
三氟化氮(NF3)是无色无味气体,它可由氨气和氟气反应制得:4NH3+3F2===NF3+3NH4F。下列说法正确的是( )A.NH4F的还原性比NH3强B.NF3的氧化性比F2强
亚氨基锂(Li2NH)是一种储氢容量高 安全性好的固体储氢材料 其储氢原理可表示为:Li2NH+H2
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是A.Li2NH中N的化合价是
河虾不宜与西红柿同食 主要原因是河虾中含+5价砷 西红柿中含有较多的维生素C 两者同食会产生有毒的+
河虾不宜与西红柿同食,主要原因是河虾中含+5价砷,西红柿中含有较多的维生素C,两者同食会产生有毒的+3价砷。据此,下列说法不正确的是()。A.该反应












