已知草酸是一种二元弱酸 草酸氢钠(NaHC2O4)溶液显酸性.(1)用电离方程式解释NaHC2O4溶
| 已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性. (1)用电离方程式解释NaHC2O4溶液显酸性的原因:______; (2)常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,比较溶液中各种离子浓度的大小关系,用>连接:______; (3)配平以下氧化还原反应方程式: 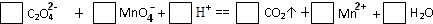 (4)称取6.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL 溶液.量取两份此溶液各25mL,分别置于两个锥形瓶中. ①第一份溶液中加入2滴酚酞试液,滴加0.25mol/L NaOH 溶液至20mL时,溶液由无色变为浅红色.该溶液被中和的H+的物质的量为______mol; ②第二份溶液滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,该溶液中还原剂的物质的量为______mol. ③原试样中H2C2O4?2H2O的物质的量为______ mol,KHC2O4的质量分数为______. |
参考解答
(1)NaHC2O4溶液显酸性的原因是:HC2O4-  H++C2O42-,电离程度大于水解程度, 故答案为:HC2O4-  H++C2O42-; (2)向10mL 0.01mol/L NaHC2O4溶液中滴加10mL 0.01mol/L NaOH溶液时,二者恰好反应,所得溶液为草酸钠溶液,在该溶液中,直接电离出的钠离子和草酸根浓度最大,但是草酸根会水解,所以c(Na+)>c(C2O42-),草酸根水解生成草酸氢根和氢氧根,溶液显碱性,水电离会生成一部分氢氧根,所以c(OH-)>c(HC2O4-)>c(H+), 故答案为:c(Na+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+); (3)反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2;5;6;2;10;8; (4)①根据中和反应的实质知道氢离子的物质的量即为氢氧化钠的物质的量,即0.25mol/L×0.02L=0.005mol, 故答案为:0.005mol; ②氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,滴加0.10mol/L 酸性KMnO4溶液至16mL时反应完全,即消耗高锰酸根离子0.10mol/L×0.016L=0.0016mol,所以该溶液中还原剂的物质的量为
故答案为:4×10-3mol; ③设原样品中含有H2C2O4?2H2O的物质的量为x,含有KHC2O4的物质的量为y,则2x+y=5×10-3mol,x+y=4×10-3mol, 解得x=10-3mol,y=3×10-3mol,所以
|
相似问题
NO是污染大气的有毒气体 为了消除NO的污染 可将它跟氨气在催化剂的作用下反应 生成水和一种完全无污
NO是污染大气的有毒气体,为了消除NO的污染,可将它跟氨气在催化剂的作用下反应,生成水和一种完全无污染的气态单质,该单质是空气的主要成分之一,这种
将0.08mol KMnO4固体(质量为12.64g)加热一段时间后 收集到a molO2;向反应后
将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以
氧化还原反应在生产 生话中应用广泛 酸性KMnO4 H2O2 Fe(NO3)3是重要的氧化剂。用所学
氧化还原反应在生产、生话中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂。用所学知识回答问题:(1)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。
金属材料是我们使用最广泛的一种材料 从古代到现代 金属材料经历了几次较大的变革。请回答下列问题。(1
金属材料是我们使用最广泛的一种材料,从古代到现代,金属材料经历了几次较大的变革。请回答下列问题。(1)下面表格中铁和铜的某些物理性质摘自某化学手册
全世界每年铜的产量为8×106t 工业上由辉铜矿(主要成分是Cu2S 其中铜元素为+1价)生产铜的主
全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O22Cu+SO2下列说法正确的是A.该反应中Cu2












