高锰酸钾和盐酸溶液可以发生以下反应:2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2
| 高锰酸钾和盐酸溶液可以发生以下反应: 2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O (1)用双线桥标出该反应中电子转移的方向和数目. (2)该反应的氧化产物是______. (3)若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量是______mol. |
参考解答
根据反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示: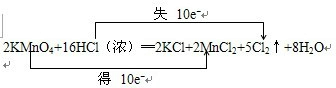 ,故答案为:  ; (2)化合价升高的元素是浓盐酸中的氯元素,所得到的氧化产物是氯气,故答案为:Cl2; (3)高锰酸钾是氧化剂,还原剂是浓盐酸,2mol高锰酸钾氧化剂消耗的16mol浓盐酸中,只有10mol浓盐酸做还原剂,所以氧化剂和被氧化的还原剂的量之间的关系为:2KMn04~10HCl,若消耗0.2mol氧化剂,则被氧化的还原剂的物质的量1mol,故答案为:1. |
相似问题
已知3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O 则下列说法不正确的是( )A
已知3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,则下列说法不正确的是( )A.Cu作还原剂,HNO3作氧化剂B.HNO3在该反应中只有部分表现出了氧化性C.
下列反应中属于非氧化还原反应的是( )A.CaO+H2O═Ca(OH)2B.2FeCl3+Cu═2
下列反应中属于非氧化还原反应的是( )A.CaO+H2O═Ca(OH)2B.2FeCl3+Cu═2FeCl2+CuCl2C.Cl2+H2O═HCl+HClOD.2FeCl2+Cl2═2FeCl3
在空气中发生的燃烧 缓慢氧化和自燃的共同点是( )A.都需要达到着火点B.都产生热量C.都要点燃D
在空气中发生的燃烧,缓慢氧化和自燃的共同点是( )A.都需要达到着火点B.都产生热量C.都要点燃D.都属于氧化反应
盐酸与氯气均可以和铁反应 从产物中比较可得出氯气比盐酸强的性质是( )A.氧化性B.还原性C.酸性
盐酸与氯气均可以和铁反应,从产物中比较可得出氯气比盐酸强的性质是( )A.氧化性B.还原性C.酸性D.金属性
写出铁粉与水蒸气在高温下发生的反应并用单线桥表示电子转移情况.______.
写出铁粉与水蒸气在高温下发生的反应并用单线桥表示电子转移情况.______.












