偏二甲肼与N2O4是常用的火箭推进剂 二者发生如下化学反应:(CH3)2NNH2(l)+2N2O4(
| 偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应: (CH3)2NNH2(l)+2N2O4(l)═2CO2(g)+3N2(g)+4H2O(g) (Ⅰ) (1)反应(Ⅰ)中氧化剂是______. (2)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g) (Ⅱ) 当温度升高时,气体颜色变深,则反应(Ⅱ)为______(填“吸热”或“放热”)反应. (3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是______.若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数______(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=______ mol/(L?s)-1. (4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是______(用离子方程式表示).向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为______mol?L-1.(NH3?H2O的电离平衡常数取Kb=2×10-5 mol?L-1) 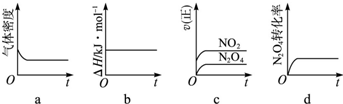 |
参考解答
| (1)反应(I)中,N2O4(l)中N元素得电子化合价降低,所以N2O4(l)是氧化剂,故答案为:氧化剂; (2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热; (3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N2O4充入一恒压密闭容器中; a、密度等于质量除以体积,平衡体系质量不变,反应体积增大,密度在反应过程中不变,说明反应达到平衡,故a符合; b、反应的焓变和反应物与生成物能量总和之差计算,与平衡无关,故b不符合; c、图象制表示正反应速率变化,不能证明正逆反应速率相同,故c不符合; d、N2O4(l)转化率不变,证明反应达到平衡,故d符合; 示意图正确且能说明反应达到平衡状态的是ad;K=
故答案为:ad;不变;0.1; (4)NO2可用氨水吸收生成NH4NO3.25℃时,将a mol NH4NO3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH4++H2O?NH3?H2O+H+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH4NO3溶于水,向该溶液滴加b L 氨水后溶液呈中性,溶液中氢氧根离子浓度=10-7mol/L;NH3?H2O的电离平衡常数取Kb=2×10-5 mol?L-1,设混合后溶液体积为1L,根据一水合氨电离平衡得到:NH3?H2O?NH4++OH-,平衡常数K=
故答案为:NH4++H2O?NH3?H2O+H+;逆向;
|
相似问题
锑(Sb)在自然界一般以硫化物的形式存在 我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一.从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:①2Sb2S
铜既能与稀硝酸反应 也能与浓硝酸反应 当铜与一定浓度硝酸反应时 可将方程式表示为:Cu+HNO3→C
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)(1)硝酸在
下列反应属于氧化还原反应 但水既不作氧化剂也不作还原剂的是( )A.CO2+H2O=H2CO3B.
下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )A.CO2+H2O=H2CO3B.2F2+2H2O=4HF+O2C.Cl2+H2O=HCl+HClOD.2Na+2H2O=2NaOH+H2↑
已知反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2 则有1molO2生
已知反应10AgF+5Cl2+5H2O═9AgCl+AgClO3+10HF+O2,则有1molO2生成时反应所转移的电子总数为( )A.4molB.9molC.10molD.5mol
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应 生成高
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.(1)请写出并配平上述反应的化学












