在酸性条件下:①KBrO3能将KI氧化成I2或KIO3 其本身被还原成Br2;②KIO3能将I-氧化
| 在酸性条件下: ①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2; ②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,其本身被还原成I2. (1)上述反应所涉及到的粒子氧化性最强的是______ (填离子符号); (2)写出一个能证明氧化性Br2>I2的离子方程式______; (3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,写出反应的化学方程式,并标明电子转移方向和数目.______;其中被氧化的元素是______,要得到1mol还原产物转移电子数目为______. |
参考解答
| (1)①KBrO3能将KI氧化成I2或KIO3,其本身被还原成Br2,则氧化性:KBrO3>KIO3,②KIO3能将I-氧化为I2,也能将Br-氧化成Br2,则氧化性:KIO3>Br2,所以氧化性最强的是KBrO3,故答案为:BrO3-; (2)反应Br2+2I-=I 2+2Br-,氧化性Br2>I2的,故答案为:Br2+2I-=I 2+2Br-; (3)向含有KI、H2SO4的溶液中加入KBrO3溶液,若氧化产物、还原产物只有I2和Br2,反应中KI被氧化失去电子,得电子被还原KBrO3,电子转移方向和数目可表示为: 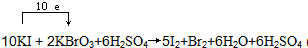 ,要得到1mol还原产物Br2,转移的电子数目为:2×(5-0)×6.02×1023=6.02×1024, 故答案为: 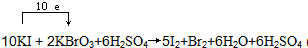 ;-1价I;6.02×1024. |
相似问题
已知反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O下列说法不正确的是( )A.Cl2
已知反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O下列说法不正确的是( )A.Cl2既是氧化剂也是还原剂B.被氧化的氯原子数是被还原的氯原子数的5倍C.氧化剂和还
工业上制备金刚砂(化学式为SiC)的反应为:SiO2+3C △ . SiC+2CO↑则氧化剂
工业上制备金刚砂(化学式为SiC)的反应为:SiO2+3C△ SiC+2CO↑则氧化剂和还原剂的物质的量之比为( )A.1:3B.3:1C.5:3D.1:2
ClO2是一种消毒杀菌剂 实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4=
ClO2是一种消毒杀菌剂,实验室可通过下列反应制得ClO2:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O下列说法正确的是( )A.KClO3在反应中得到电
在下列反应中氧化剂和还原剂为同一物质的是( )A.Cl2+H2O═HCl+HClOB.Fe2O3+
在下列反应中氧化剂和还原剂为同一物质的是( )A.Cl2+H2O═HCl+HClOB.Fe2O3+3CO△ 2Fe+3CO2C.2F2+2H2O═4HF+O2D.2Na+2H2O═2NaOH+H2↑
化合物BrFx能够与水反应 产物有溴酸 氢氟酸 单质溴和氧气 则下列关于该反应的说法正确的是( )
化合物BrFx能够与水反应,产物有溴酸、氢氟酸、单质溴和氧气,则下列关于该反应的说法正确的是( )A.BrFx是还原剂,HF是氧化产物B.水是氧化剂,O2












