有四种短周期元素 它们的结构 性质等信息如下表所述。元素结构 性质等信息A是短周期中(除稀有气体外)
有四种短周期元素,它们的结构、性质等信息如下表所述。
请根据表中信息填写: (1)A原子的核外电子排布式 。 (2)B元素在周期表中的位置 ; 离子半径:B A(填“大于”或“小于”)。 (3)C原子的电子排布图是 ,其原子核外有 个未成对电子,能量最高的电子为 轨道上的电子,其轨道呈 形。 (4)D原子的电子排布式为 ,D-的结构示意图是 。 (5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为 ,与D的氢化物的水化物反应的化学方程式为 。 |
参考解答
| (1)1s22s22p63s1 (2)第3周期第ⅢA族 小于 (3) 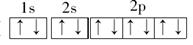 3 p 纺锤 3 p 纺锤(4)1s22s22p63s23p5或[Ne3s23p5 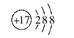 (5)NaOH+Al(OH)3=NaAlO2+2H2O 3HCl+Al(OH)3=AlCl3+3H2O |
| 根据题中信息可推出:A为Na,B为Al,C为N,D为Cl。 (1)Na原子核外电子排布式为1s22s22p63s1。 (2)B为Al,其在元素周期表中的位置为第3周期第ⅢA族,Na+与Al3+核外电子排布相同,核电荷数Al3+大于Na+,故r(Al3+)<r(Na+)。 (3)C为N,其电子排布图为 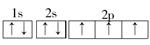 ,其中有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈纺锤形。 ,其中有3个未成对电子,能量最高的为p轨道上的电子,其轨道呈纺锤形。(4)D为Cl,其核外电子排布式为1s22s22p63s23p5,简化电子排布式为 [Ne3s23p5,Cl-的结构示意图为+17 288。 (5)本题考查Al(OH)3分别与NaOH、盐酸反应的方程式。 Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3+3HCl=AlCl3+3H2O。 |
相似问题
在短周期元素中 原子最外电子层只有1个或2个电子的元素是( )A.金属元素B.稀有气体元素C.非金
在短周期元素中,原子最外电子层只有1个或2个电子的元素是()A.金属元素B.稀有气体元素C.非金属元素D.无法确定为哪一类元素
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷 在工业生产和科技领域有重要用途。(
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。(1)Al与NaOH溶液反应的离子方程式为。(2)下列实验能比较
已知1~18号元素的离子aW3+ bX+ cY2- dZ-都具有相同的电子层结构 下列关系正确的是(
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )A.质子数:c>dB.离子的还原性:Y2->Z-C.氢化物的稳定
四种元素A B C D 其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的
四种元素A、B、C、D,其中A元素原子的原子核内只有一个质子;B的基态原子s能级的总电子数比p能级的总电子数多1;C元素的原子最外层电子数是次外层的3倍;
某元素X的气态氢化物的化学式为H2X 则X的最高价氧化物的水化物的化学式为 A.H2XO3B.H2X
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为 A.H2XO3B.H2XO4C.H3XO4D.HXO3












