元素X Y Z W的原子序数依次增大 且原子序数之和为22 最外层电子数之和为16 在化合物Y2X2
元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。下列说法正确的是
|
参考解答
| D |
试题分析:根据题意可推知这几种元素分别是:X是H;Y是C;Z是N;W是O;它们形成的化合物分别是:C2H2、N2H4、H2O2。A.同一周期是元素,原子序数越大,原子半径就越小;不同周期的元素,元素的原子核外电子层数越多,原子半径就越大。因此X、Y、Z、W的原子半径的大小关系为Y >Z> W > X 。错误。B. 在化合物C2H2中共用5对电子对;在N2H4中共用5对电子对;H2O2中共用3对电子对;,分子所含的共用电子对数不相等。错误。C. 与元素Y、Z相比,元素W形成的简单氢化物最稳定是因为其非金属性最强,原子半径最小,形成的共用电子对结合的最牢固。错误。D. X、Y、Z、W四种元素可形成化学式为H7C2NO2的物质,其结构可能是HOCH2—O—CH2—NH2或 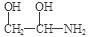 。 。 |
相似问题
(13分)下图是元素周期表的一部分 表中的①—⑩中元素 用化学用语填空回答:族周期I AIIAIII
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:族周期I AIIAIIIAⅣAVAⅥAⅦA0二①②③三④⑤⑥⑦⑧四⑨⑩(1)在这些元素
(13分)Ⅰ.通常状况下 X Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气
(13分)Ⅰ.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I
已知X Y Z W为短周期主族元素 在周期表中的相对位置如图所示 下列说法正确的是XYZW A.若四
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是XYZWA.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是
下列各组顺序的排列错误的是A.半径:F—>Na+>Mg2+>Al3+B.沸点:H2O< H2S
下列各组顺序的排列错误的是A.半径:F—>Na+>Mg2+>Al3+B.沸点:H2O< H2S < H2SeC.酸性:HClO4>H2SO4>H3PO4D.熔点:SiO2>NaCl>CO2
以下是1-18号元素某性质的递变规律 Y轴代表的是 A.原子
以下是1-18号元素某性质的递变规律,Y轴代表的是A.原子半径B.金属性C.非金属性D.最外层电子数












