亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸 很不稳定 通常在室温下立即分解。(1)写出亚硝酸的电离
| 亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。 (1)写出亚硝酸的电离方程式: 。 (2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。 (3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。 a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸 (4)碱性工业废水中的N 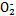 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。①写出上述反应的离子方程式: 。 ②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。 (5)酸性工业废水中的N 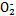 可用尿素除去。尿素 可用尿素除去。尿素( 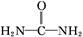 )与N )与N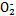 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。 |
参考解答
(1)HNO2 H++N H++N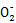 (2)NO (3)bc (2)NO (3)bc(4)①2Al+N 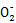 +OH-+2H2O +OH-+2H2O 2Al 2Al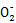 +NH3·H2O ②减小 +NH3·H2O ②减小(5)15 |
(2)NaNO2中氮元素的化合价降低1价,为+2价;(3)由(2)可知HNO2具有氧化性,所以c选项不合适,碳酸的酸性小于HNO2,b选项不合适;(4)找出氧化剂、还原剂及还原产物、氧化产物可得Al+N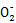 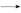 Al Al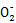 +NH3·H2O,依据化合价守恒可知2Al+N +NH3·H2O,依据化合价守恒可知2Al+N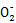 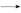 2Al 2Al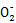 +NH3·H2O,依据电荷守恒可知2Al+N +NH3·H2O,依据电荷守恒可知2Al+N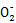 +OH- +OH-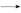 2Al 2Al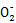 +NH3·H2O,补“H2O”配“H”得2Al+N +NH3·H2O,补“H2O”配“H”得2Al+N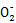 +OH-+2H2O +OH-+2H2O 2Al 2Al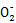 +NH3·H2O; +NH3·H2O;(5)写出方程式2N 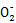 +CH4N2O+2H+ +CH4N2O+2H+ 2N2↑+CO2↑+3H2O,n(混合气体)='0.75' mol,n(CO2)='0.25' mol,n(尿素)='0.25' mol 2N2↑+CO2↑+3H2O,n(混合气体)='0.75' mol,n(CO2)='0.25' mol,n(尿素)='0.25' mol |
相似问题
下列离子方程式书写正确的是A.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)
下列离子方程式书写正确的是A.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2OB.H218O中
下列离子方程式书写正确的是 ①等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合 Ba2+ +
下列离子方程式书写正确的是①等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合 Ba2+ + 2OH – + NH4+ + HCO3 – = BaCO3↓+ NH3
下列离子方程式书写正确的是A.氢氧化钡溶液与硫酸的反应: OH-+ H+= H2OB.铁与稀硫酸反应
下列离子方程式书写正确的是A.氢氧化钡溶液与硫酸的反应: OH-+ H+= H2OB.铁与稀硫酸反应: 2Fe+6H+=2Fe3++ 3H2↑C.碳酸钙与盐酸反应: CaC
下列离子方程式正确的是 ( )。A.氢氧化镁与稀盐酸反应:H++OH-===H2OB.Al
下列离子方程式正确的是 ( )。A.氢氧化镁与稀盐酸反应:H++OH-===H2OB.AlCl3溶液中加入少量氨水:Al3++3OH-===Al(OH)3↓C.铜溶于稀硝酸:3C
能正确表示下列反应的离子方程式的为( )A.硫化亚铁溶于稀硝酸中:FeS+2H+Fe2++H2S↑
能正确表示下列反应的离子方程式的为( )A.硫化亚铁溶于稀硝酸中:FeS+2H+Fe2++H2S↑B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2OAl+4N+2H2OC.硫代硫












