将0.03 mol Cl2缓缓通入含0.02mol H2SO3和0.02 mol HBr的混合溶液中
将0.03 mol Cl2缓缓通入含0.02mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)( )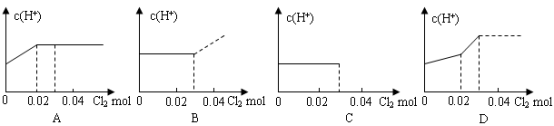 |
参考解答
| A |
试题分析:将Cl2缓缓通入含H2SO3和HBr的混合溶液中,由于亚硫酸的还原性强于溴化氫的还原性,所以,氯气优先和亚硫酸反应,所以刚开始的一段,氢离子浓度会增大,原因是:H2O+Cl2+H2SO3= H2SO4+ 2HCl ,所以氯气的用量从0-0.02mol时,氢离子浓度会增大,然后把亚硫酸反应完后接下来和溴化氫反应:2HBr+Cl2 = Br2+ 2HCl,反应前后氢离子浓度不变。故选A。 点评:解答本题需要注意的是,对于同一种氧化剂和多种还原剂反应时,优先的是跟还原性强的物质发生氧化还原反应。 |
相似问题
已知有如下反应:①2BrO3-+Cl2═Br2+2ClO3- ②ClO3-+5Cl-+6H+═3Cl
已知有如下反应:①2BrO3-+Cl2═Br2+2ClO3-,②ClO3-+5Cl-+6H+═3Cl2+3H2O,③2FeCl3+2KI═2FeCl2+2KCl+I2,④2FeCl2+Cl2═2FeCl3.下列各微粒氧化能力由
I.在足量的氯化亚铁溶液中加入少量(1-2滴)液溴 振荡后溶液变为黄色.(1)甲同学认为是Br2单质
I.在足量的氯化亚铁溶液中加入少量(1-2滴)液溴,振荡后溶液变为黄色.(1)甲同学认为是Br2单质溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液
有NH4+ Fe3+ NO3- Fe2+ H+ 和H2O六种微粒 分别属于一个氧化还原反应中的反应物
有NH4+、Fe3+、NO3-、Fe2+、H+ 和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物。(1).氧化剂与还原剂的物质的量之比为(2).若有l mo
为验证氧化性:Cl2>Fe3+>SO2 某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略
为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程:Ⅰ.打开弹簧夹K1-K4,通
根据下列化学方程式:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 2FeC
根据下列化学方程式:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O、2FeCl2+Cl2=2FeCl3、2FeCl3+2KI=2FeCl2+2KCl+I2,判断各物质氧化性由大到小的顺序正确的是A












