实验室用铜制备CuSO4溶液有多种方案 某实验小组给出了以下三种方案:请回答有关问题:(1)甲方案:
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案: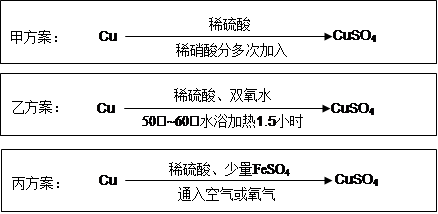 请回答有关问题: (1)甲方案: ①写出该反应的离子方程式 ; ②为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。 (2)乙方案:将6.4g铜丝放到90mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入40mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0g【已知有关摩尔质 量:M(Cu)=64g/mol, M(CuSO4·5H2O) =250g/mol】。 ①反应时温度控制在50℃~60℃,不宜过高的原因是 ; ②本实验CuSO4·5H2O的产率为 。 (3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。 ①物质A可选用以下的 (填序号);
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条): 、 。 |
参考解答
| (1)①3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (3分); ②3:2(2分) (2)①双氧水受热易分解造成损耗(2分); ②80%(3分) (3)①CD(2分); ②作催化剂(或起催化作用,2分) (4)无污染;原料利用率高(或常温下反应,耗能少;原料便宜,成本低等)(2分) |
试题分析:(1)①铜与稀硫酸、稀硝酸的混合液反应生成铜离子、NO、水,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O; ②硫酸铜的化学式中Cu2+与SO42-的个数比是1:1,离子方程式中Cu2+与NO3-的个数比是是3:2,所以n(H2SO4):n(HNO3)=3:2; (2)①因为过氧化氢受热易分解,温度过高,造成过氧化氢的损失,产率降低; ②604gCu的物质的量是0.1mol,硫酸的物质的量是0.135mol,所以硫酸过量,理论上应生成0.1molCuSO4·5H2O,质量是25.0g,实际得到CuSO4·5H2O 20.0g,所以CuSO4·5H2O的产率是20.0g/25.0g×100%=80%; (3)①加物质A调节pH至4目的是降低溶液酸度,使铁元素沉淀,同时不引入新杂质,所以应选择CuCO3、Cu2(OH)2CO3,二者与硫酸反应生成硫酸铜、二氧化碳气体放出,符合题目要求,而ABE均会引入新杂质,答案选CD。 ②反应中加入少量FeSO4可加速铜的氧化,而FeSO4不与溶液中的任何物质反应,所以FeSO4的作用只能是催化剂的作用; (4)与甲、乙比,丙的优点是不会产生污染,耗能少,原料便宜,节约原料等。 |
相似问题
将一定量的Cl2通入一定浓度的苛性钾溶液中 两者恰好完全反应(已知反应过程放热) 生成物中有三种含氯
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n
久置的氯水与新制的氯水比较 下列结论正确的是 [ ]A.颜色相同 B.都能使有色布条褪色 C
久置的氯水与新制的氯水比较,下列结论正确的是 [ ]A.颜色相同 B.都能使有色布条褪色 C.pH相同 D.加入AgNO3溶液都能产生白色沉淀
Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。(一)常用下列途径制备海波:已
Na2S2O3·5H2O(俗称海波或大苏打)是照相业常用的一种定影剂。(一)常用下列途径制备海波:已知反应:4FeS+7O2 2Fe2O3+4SO2、Na2SO3+SNa2S2O3(1)计算
下列氯化物 不能用金属和氯气直接反应制得的是[ ]A.CuCl2 B.FeCl2 C.MgC
下列氯化物,不能用金属和氯气直接反应制得的是[ ]A.CuCl2 B.FeCl2 C.MgCl2 D.KCl
下列叙述正确的是[ ]A.铝制容器可盛装热的H2SO4 B.AgI胶体在电场中自由运动 C.
下列叙述正确的是[ ]A.铝制容器可盛装热的H2SO4 B.AgI胶体在电场中自由运动 C.K与水反应比Li与水反应剧烈D.红磷在过量Cl2中燃烧生成PCl3












