(13分)硫及其化合物有广泛的应用 对SO2性质的研究是高中化学教学的一项重要内容。(1)对比研究是
| (13分)硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。 (1)对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3组,则第2组中物质M的化学式是 。
(2)某校化学学习小组用下图所示的实验装置研究SO2的性质。 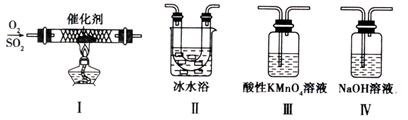 ①在装置Ⅰ中发生SO2的催化氧化反应,其化学方程式是 。 ②若按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,(已知:SO3熔点 16.8℃; SO2沸点—10℃。)装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+的同时pH降低,则该反应的离子方程式是 。 ③若按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,如果装置Ⅳ中有30mL 2.5mol/LNaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是 。 |
参考解答
| (13分) (1)Na2SO3。(2分) (2)①2SO2+O2 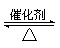 2SO3(2分,没标条件或没配平扣1分,二者都有只扣1分) 2SO3(2分,没标条件或没配平扣1分,二者都有只扣1分) ②使SO3凝结成固体与SO2分离;(2分,只要合理即给分) 5SO2+2MnO4—+2H2O=5SO42—+2Mn2++4H+(3分,没配平扣1分) ③SO2+NaOH=NaHSO3(4分) |
试题分析:(1)根据第3组的化学式判断,M是Na2SO3; (2)①装置I发生的二氧化硫的催化氧化反应,化学方程式为2SO2+O2  2SO3 2SO3②三氧化硫的熔点较低,二氧化硫的沸点较低,所以装置Ⅱ的作用是使SO3凝结成固体与SO2分离;二氧化硫与酸性高锰酸钾溶液发生氧化还原反应,生成硫酸根离子和Mn2+、水,离子方程式为5SO2+2MnO4—+2H2O=5SO42—+2Mn2++4H+; ③30mL 2.5mol/LNaOH溶液中氢氧化钠的物质的量是0.075mol,反应后增重4.8g,即二氧化硫的质量是4.8g,物质的量是0.075mol,二者的物质的量之比是1:1,所以生成的产物是亚硫酸氢钠,化学方程式为SO2+NaOH=NaHSO3。 |
相似问题
下列叙述中 正确的是[ ]A.氨气喷泉实验说明氨气极易溶解于水B.NaHCO3的热稳定性比N
下列叙述中,正确的是[ ]A.氨气喷泉实验说明氨气极易溶解于水B.NaHCO3的热稳定性比Na2CO3强 C.过量铁粉加入FeCl3溶液中,充分反应后溶液中的阳离子
为预防H1N1甲型流感 每天用“84”消毒液(NaClO溶液)消毒 下列说法不正确的是[ ]
为预防H1N1甲型流感,每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是[ ]A NaClO溶液的消毒原理是使蛋白质变性 B l mol Cl2与足量NaOH溶
如图是一种验证某气体化学性质的实验装置 图中B为活塞。如先打开B 在A处通入干燥氯气 C中红布条颜色
如图是一种验证某气体化学性质的实验装置,图中B为活塞。如先打开B,在A处通入干燥氯气,C中红布条颜色无变化;当关闭B时,C中红布条颜色褪去。则D瓶中盛
下列物质能使品红溶液褪色 且褪色原理基本相同的是( )①活性炭;②氯水;③二氧化硫;④臭氧;⑤过氧
下列物质能使品红溶液褪色,且褪色原理基本相同的是()①活性炭;②氯水;③二氧化硫;④臭氧;⑤过氧化钠;⑥双氧水A.①②④B.②③⑤C.②④⑤⑥D.
下列关于二氧化硫性质的说法正确的是A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性B.含有酚酞的氢
下列关于二氧化硫性质的说法正确的是A.氯水中通入一定量二氧化硫气体可增强氯水的漂白性B.含有酚酞的氢氧化钠溶液中通入二氧化硫气体,溶液变无色,说












