图中 B D E F G是氧化物 F K是氢化物 C H是日常生活中最常见的金属单质 J是气态非金属
图中,B、D、E、F、G是氧化物,F、K是氢化物,C、H是日常生活中最常见的金属单质,J是气态非金属单质,O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志(图中部分反应物和生成物没有列出).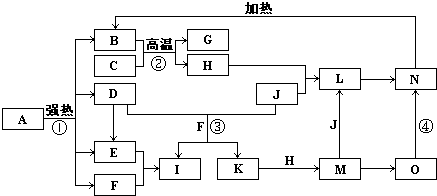 请按要求回答: (1)写出L的化学式______; (2)写出:反应③的离子方程式______;反应④的化学方程式______; (3)反应②在工业生产上的用途是______; (4)反应①是分解反应,反应中生成的B、D、E、F的物质的量之比为1:1:1:14,则反应①的化学方程式为______. |
参考解答
| C、H是日常生活中最常见的金属单质,应该为Al和Fe,结合转化关系中,B+C=G+H,可知是铝热反应,C为Al,H为Fe,G是Al2O3,O是白色沉淀且B、H、L、M、N、O中含有同种元素,证明O是Fe(OH)2,N为Fe(OH)3,B为Fe2O3,J是气态非金属单质,能发生反应和铁直接生成L,也可以利用铁和K反应生成的M和J反应生成L,所以L为FeCl3,M为FeCL2,判断K为HCl,依据转化关系中的反应,D+J(Cl2)+F(H2O)=I(H2SO4)+K(HCl),推断D为SO2;I是基础化学工业的重要产品,其消费量是常被视为一个国家工业发达水平的一种标志,证明是I是H2SO4,B、D、E、F、G是氧化物,F、K是氢化物,所以E为SO3,F为H2O; (1)依据上述推断,L是FeCl3,化学式为FeCl3 ,故答案为:FeCl3; (2)反应③是二氧化硫和氯气在水溶液中反应的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-;反应④是氢氧化亚铁被氧化为氢氧化铁,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3, 故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-; 4Fe(OH)2+O2+2H2O=4Fe(OH)3; (3)反应②是铝热反应,在工业生产上的用途是焊接钢轨(或冶炼钒、铬、锰等金属),故答案为:焊接钢轨; (4)反应①是分解反应,反应中生成的B(Fe2O3)、D(SO2)、E(SO3)、F(H2O)的物质的量之比为1:1:1:14,依据反应前后原子守恒可以推断出A的化学式,为FeSO4?7H2O,配平化学方程式得到:2(FeSO4?7H2O)
故答案为:2(FeSO4?7H2O)
|
相似问题
表所列各组物质中 物质之间通过一步反应能实现如图所示转化的是( )XYZ①CuCuOCu(OH)2
表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )XYZ①CuCuOCu(OH)2②CH3CH2OHCH3CHOCH2=CH2③SSO3H2SO4④NONO2HNO3⑤FeCl2FeFe
A-H及X均为中学化学常见物质 X是一种金属单质 A B是非金属单质且A在常温下为气体。它们在一定
A-H及X均为中学化学常见物质,X是一种金属单质,A、B是非金属单质且A在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。 试回答下
常温下 A是气态单质 B C D都是含A元素的化合物 转化关系如图所示.(1)分别写出B D的化学式
常温下,A是气态单质,B、C、D都是含A元素的化合物,转化关系如图所示.(1)分别写出B、D的化学式:B______D______(2)写出下列化学方程式:在工业上由
下图中的反应①是重要的电化学工业反应 反应②可用于制备新型消毒净水剂Na2FeO4。常温下B C为气
下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4。常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物
X Y Z W均为中学化学中常见物质 一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是( )A.若W是强氧化性的单质,则X可能












