(15分)材料在人类生活 生产中发挥着重要的作用。(1)钠 铝 铁是常见的金属。①在三种金属元素中
| (15分)材料在人类生活、生产中发挥着重要的作用。 (1)钠、铝、铁是常见的金属。 ①在三种金属元素中,所形成氧化物种类最多的是 ;三种元素形成的氧化物中属于碱性氧化物的有 种。 ②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为 , 得到的胶状沉淀物在医疗上治疗胃酸过多,利用的原理用离子方程式表示为 。 ③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为 ,可能存在的阳离子为 ,一定不存在的阳离子为 。 ④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为 ,要得到1mol金属铁,需要铝的质量 g。 (2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳。若向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为 。 |
参考解答
| (1)① Fe或铁(1分);3(1分) ② Al3+ + 3NH3.H2O = Al(OH)3↓+ 3NH4+(2分);Al(OH)3 + 3H+ = Al3+ + 3H2O(2分) ③Fe2+(1分),Cu 2+(1分),Fe3+(1分) ④2Al + Fe2O3 = Al2O3+ 2Fe(2分) ,27(2分) (2)22.4L(2分) |
试题分析:(1)钠、铝、铁是常见的金属。 ①在三种金属元素中,所形成氧化物种类最多的是铁;三种元素形成的氧化物中属于碱性氧化物的有3种。 ②向盛有硫酸铝溶液的试管中滴加氨水,反应的离子方程式为Al3+ + 3NH3.H2O = Al(OH)3↓+ 3NH4+,Al(OH)3不和弱碱反应; 得到的胶状沉淀物在医疗上治疗胃酸过多,胃酸是盐酸,利用的原理用离子方程式表示为Al(OH)3 + 3H+ = Al3+ + 3H2O。 ③向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,剩余固体中有铜无铁,则溶液中一定存在的阳离子为Fe2+,可能存在的阳离子为Cu 2+,一定不存在的阳离子为Fe3+。,有铜剩余,就一定不会有三价铁;  ④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为2Al + Fe2O3 = Al2O3+ 2Fe,要得到1mol金属铁,由定量关系可得需要铝的物质的量是1mol,所以质量是27g。 ④生产中曾用铝热反应(铝与铁的氧化物反应生成氧化铝和铁)焊接钢轨,则铝与氧化铁发生反应的化学方程式为2Al + Fe2O3 = Al2O3+ 2Fe,要得到1mol金属铁,由定量关系可得需要铝的物质的量是1mol,所以质量是27g。(2)工业上,在电炉中用炭粉还原二氧化硅可制得硅和一氧化碳。 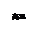 SiO2 + 2C = 2CO↑ + Si 60 2×22.4 30 x X=22.4 所以向电炉里加入适量炭粉和30g二氧化硅,通电后反应,生成的一氧化碳在标况下的体积为22.4L。 点评:本题考查是无机物之间的反应的问题,要求学生熟悉常见的物质间的反应,会用定量关系进行计算。 |
相似问题
用11.5g金属钠放入水中 要使100个水分子溶有1个钠离子 则需加水 g。
用11 5g金属钠放入水中,要使100个水分子溶有1个钠离子,则需加水g。
某同学将一小块金属钠放入烧杯内的水中反应 下列描述错误的是A.钠与水反应放出的热使钠熔成一个小球B.
某同学将一小块金属钠放入烧杯内的水中反应,下列描述错误的是A.钠与水反应放出的热使钠熔成一个小球B.钠浮在水面上,四处游动C.钠消失后,向烧杯中滴
在由NaOH Na2O2组成的化合物中钠元素的质量分数为58% 则混合物中氢元素的质量分数近似为(
在由NaOH、Na2O2组成的化合物中钠元素的质量分数为58%,则混合物中氢元素的质量分数近似为()A.6%B.2%C.4%D.无法确定
(8分)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。(1)碳酸钠的化学式是
(8分)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。(1)碳酸钠的化学式是,俗称,其水溶液显性(填“酸”、“碱”或“中”), 在焰色反应中呈
为了确定碳酸氢钠固体中是否含有碳酸钠。下列实验操作及判断中正确的是A.观察加热时能否放出气体B.观察
为了确定碳酸氢钠固体中是否含有碳酸钠。下列实验操作及判断中正确的是A.观察加热时能否放出气体B.观察加盐酸时能否放出气体C.溶于水中,加入澄清石灰












