I.纯碱 烧碱等是重要的化工原料。(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A
I.纯碱、烧碱等是重要的化工原料。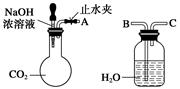 (1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________, 若其他操作不变,将A与C连接,可观察到的现象是__________________________。 (2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是: A.NaOH和Na2CO3;B. ;C. ;D. 。 (3)设计实验确定(2)中白色固体中存在A项中的阴离子:
II.化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究: 查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。 牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应 后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。 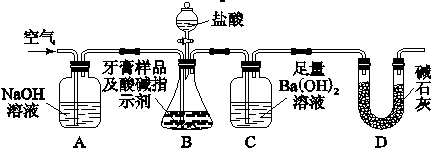 依据实验过程回答下列问题: (1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B,C中的反应物外,还有: 。 (2)C中反应生成BaCO3的离子方程式是 。 (3)下列各项措施中,不能提高测定准确度的是( ) A.在加入盐酸之前,应排净装置内的CO2气体 B.滴加盐酸不宜过快 C.在A~B之间增添盛有浓硫酸的洗气装置 D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置 (4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________。 (5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_________________________________。 (6)装置中U形管D中的碱石灰的作用是_____________________________。 |
参考解答
| I.(1)水沿导管由广口瓶进入烧瓶 广口瓶中的长导管口有气泡产生 (2)Na2CO3 Na2CO3和NaHCO3 NaHCO3 (3)
II.(1)把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收 (2)Ba2++2OH-+CO2=BaCO3↓+H2O (3)C D (4)25% (5)B中水蒸气,氯化氢气体等进入C装置中 (6)防止空气中的CO2进入C |
试题分析:I.(1)CO2+2NaOH=Na2CO3+H2O由于二者发生反应导致A装置的气体压强减小,B装置中的水在大气压的作用下经导气管进入A装置。若其他操作不变,将A与C连接,可观察到的现象是广口瓶中的长导管口冒气泡。(2)向NaOH溶液中通入一定量CO2,可能发生的反应为:2NaOH+CO2= Na2CO3+H2O,NaOH+CO2= NaHCO3。所以结晶后得到白色固体,该白色固体的组成可能是:A.NaOH和Na2CO3;B.Na2CO3;C.Na2CO3和NaHCO3;D.NaHCO3。(3)①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液,产生白色沉淀证明含有CO32-离子。②过滤,取少量滤液于试管中,滴加酚酞,滤液变红证明含有OH-。 II.(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B,C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收。(2)C中反应生成BaCO3的离子方程式是Ba2++2OH-+ CO2= BaCO3↓+H2O。(3)A.在加入盐酸之前,应排净装置内的CO2气体可以减少空气中的二氧化碳对产生沉淀的影响,减小实验误差,提高实验的准确度。错误。B.滴加盐酸不宜过快可以是反应产生的二氧化碳气体被氢氧化钡溶液充分吸收,提高反应的准确度。错误。C.在A~B之间增添盛有浓硫酸的洗气装置,吸收水分对二氧化碳含量的测定无然后影响。正确。D.若在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置,则由反应物挥发出来的HCl杂质又与其反应产生二氧化碳气体,使测定结果偏大。正确。故选项为:C D。(4)由方程式CaCO3+2HCl=CaCl2+ CO2↑+H2O; CO2+ Ba(OH)2= BaCO3↓+H2O。可得关系式CaCO3-- BaCO3。即100g CaCO3—197g BaCO3.今BaCO3质量为3.94 g,所以含有的CaCO3的质量为2.0g.样品中碳酸钙的质量分数为(2.0g÷8.0g)×100%=25%.(5)B中水蒸气,氯化氢气体等进入C装置中.(6)装置中U形管D中的碱石灰的作用是防止空气中的CO2进入C ,以防止影响实验测定结果的准确性。 |
相似问题
在实验室模拟工业生产碳酸钠:一定温度下 往一定量饱和NaCl溶液中通入氨气达到饱和后 再不断通入CO
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。(1
将一块钠投入到盛有煤油和水的烧杯中 观察到的现象可能是( )A.钠在水层中反应并四处游动B.钠停
将一块钠投入到盛有煤油和水的烧杯中,观察到的现象可能是()A.钠在水层中反应并四处游动B.钠停留在煤油层中不发生反应C.钠在煤油中的液面上反应并四
一定温度下 mg某物质在足量氧气中充分燃烧 将其产物立即与过量的Na2O2固体充分反应 固体质量增加
一定温度下,mg某物质在足量氧气中充分燃烧,将其产物立即与过量的Na2O2固体充分反应,固体质量增加了ng,且m<n,在①H2②CO ③CO2④CH3COOH⑤CH3CHO
可用于判断NaHCO3粉末中混有Na2CO3的实验方法是A.加热时有气体放出B.滴加盐酸时有无气泡生
可用于判断NaHCO3粉末中混有Na2CO3的实验方法是A.加热时有气体放出B.滴加盐酸时有无气泡生成C.溶于水后滴加氯化钡溶液,有白色沉淀生成D.溶于水后滴
(4分)请用方程式写出过氧化钠应用于呼吸面具的原理:________________________
(4分)请用方程式写出过氧化钠应用于呼吸面具的原理:_______________________________________________________












