(1)写出电解饱和食盐水的离子方程式 (2)用右图所示装置电解500mL2mol·L
(1)写出电解饱和食盐水的离子方程式 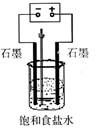 (2)用右图所示装置电解500mL2mol·L-1食盐水可制取一种消毒液,在通电过程中不断搅拌溶液(使阳极产物全部溶解在溶液中)溶液的pH(填写字母) A.逐渐增大; B.逐渐减小; C.保持不变 当阳极有氧气生成时,停止通电最终所得溶液中的溶质主要成分是 ; 假设电解过程中阳极产物无逸出,溶液加水至500mL,消毒液的浓度是 mol·L-1 (3)向上述制取的消毒液中通入CO2气体,可以增强消毒效果,写出反应的离子方程式 |
参考解答
(1)2Cl-+2H2O 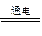 Cl2↑+H2↑+2OH-(2分) Cl2↑+H2↑+2OH-(2分)(2)A;NaClO;(每空1分,共2分) 2(2分) (3)2ClO-+CO2+H2O |
本题考查电解原理及规律,试题;(1)电解饱和食盐水的离子反应方程式为:2Cl-+2H2O 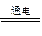 Cl2↑+H2↑+2OH-;(2)电解食盐水,在通电过程中氢氧化钠的浓度逐渐增大,所以溶液的pH将不断增大;阳极产物为氯气与氢氧化钠反应生成NaClO、NaCl、水,当阳极有氧气生成时,说明氯化钠全部电解,最终所得溶液中的溶质主要成分为NaClO; Cl2↑+H2↑+2OH-;(2)电解食盐水,在通电过程中氢氧化钠的浓度逐渐增大,所以溶液的pH将不断增大;阳极产物为氯气与氢氧化钠反应生成NaClO、NaCl、水,当阳极有氧气生成时,说明氯化钠全部电解,最终所得溶液中的溶质主要成分为NaClO;根据:2NaCl+2H2O 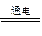 Cl2↑+H2↑+2NaOH Cl2+NaOH=NaCl+NaClO+H2O Cl2↑+H2↑+2NaOH Cl2+NaOH=NaCl+NaClO+H2O 2NaCl ~ NaClO 1mol 1mol 0.5L×2mol·L-1 n(NaClO) n(NaClO)=1mol c(NaClO)=2mol·L-1 (3)消毒液中通入CO2气体,可生成次氯酸,增强消毒效果, 2ClO-+CO2+H2O |
相似问题
某碱金属的氧化物中含氧29% 其相对分子质量为110 则其化学式为
某碱金属的氧化物中含氧29%,其相对分子质量为110,则其化学式为,它与CO2反应的化学方程式为。
取Na2CO3 NaHCO3和NaCl的混合物100 g 加热到质量不再继续减少为止 剩下的残渣为8
取Na2CO3、NaHCO3和NaCl的混合物100 g,加热到质量不再继续减少为止,剩下的残渣为84 5 g,取残渣8 45 g放入烧瓶中,缓缓加入20 g盐酸(过量)至气泡不再
关于钠和钾的性质比较中 不正确的是( )A.钾的还原性比钠强B.钾失电子能力比钠强C.钾离子还
关于钠和钾的性质比较中,不正确的是( )A.钾的还原性比钠强B.钾失电子能力比钠强C.钾离子还原性比钠离子强D.钾离子氧化性比钠离子弱
向氢氧化钠溶液中慢慢地通入二氧化碳气体 反应生成正盐 当继续通入过量二氧化碳时 正盐便转化成酸式盐。
向氢氧化钠溶液中慢慢地通入二氧化碳气体,反应生成正盐,当继续通入过量二氧化碳时,正盐便转化成酸式盐。(1)写出上述反应的化学方程式①。②。(2)
⑴加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化 剩余固体的质量为8.45g 求混合物中碳酸钠
⑴加热10 0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8 45g,求混合物中碳酸钠的质量分数。(列出计算过程)⑵过氧化钠与铝粉混合物共1












